题目内容
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是 ( )。
| A.氢铝化合物与水反应生成氢氧化铝和氢气 |
| B.氢铝化合物中铝显+3价,氢显-1价 |
| C.铝与水蒸气在高温下反应可生成氢铝化合物 |
| D.氢铝化合物具有强还原性 |
C
解析

练习册系列答案
相关题目
下列物质转化在给定条件下能实现的是
①Al2O3 NaAlO2(aq)
NaAlO2(aq) 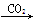 Al(OH)3
Al(OH)3
②S SO3
SO3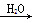 H2SO4
H2SO4
③饱和NaCl(aq) 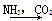 NaHCO3
NaHCO3 Na2CO3
Na2CO3
④Fe2O3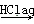 FeCl3(aq)
FeCl3(aq)  无水FeCl3
无水FeCl3
⑤MgCl2(aq)  Mg(OH)2
Mg(OH)2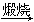 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
工业生产中常涉及到一些重要的中学化学反应,以下有关叙述正确的是
| A.工业上,用焦炭在高温下还原二氧化硅制得粗硅 |
| B.通常将氯气通入到饱和石灰水中制得大量漂白粉 |
C.工业制硫酸将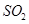 氧化成 氧化成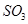 的条件一般选择高温、高压、催化剂 的条件一般选择高温、高压、催化剂 |
| D.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来 |
据国外媒体报道,“火星快车”号和“金星快车”号探测器分别在火星和金星大气层中发现了一种非常特殊的气态化合物。这种化合物的存在不但会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。它的结构式为16O=C=18O。下列说法正确的是
| A.16O与18O为同种原子 |
| B.16O=C=18O与16O=C=16O互为同位素 |
| C.16O=C=18O与16O=C=16O的化学性质几乎相同 |
| D.16O=C=18O与NaO2反应生成的氧气中含18O |
某地污水中含有Zn2+、Hg2+、Fe3+、Cu2+四种阳离子。甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
下列判断正确的是( )。
| A.三种实验方案都能制得纯净的铜 |
| B.乙方案中加过量铁粉可以将四种阳离子全部还原 |
| C.甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 |
| D.丙方案会产生环境污染 |
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )。
| A.①②③④⑤ | B.①②③⑤ |
| C.①②③④ | D.②③④⑤ |
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是 ( )。
| A.①②③④⑤ | B.①②③⑤ |
| C.①②③④ | D.②③④⑤ |
物质的量为0.10 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为 ( )。
| A.3.2 g | B.4.0 g | C.4.2 g | D.4.6 g |
下列关于金属元素的叙述正确的是( )
| A.金属元素的单质只有还原性,其离子只有氧化性 |
| B.金属元素的单质在常温下均为固体 |
| C.金属元素在不同化合物中化合价均相同 |
| D.大多数金属元素的单质为电的良导体 |