题目内容
已知:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol.向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀盐酸;②浓H2SO4;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的关系正确的是( )
| A、△H1>△H2>△H3 |
| B、△H3>△H1>△H2 |
| C、△H1=△H3>△H2 |
| D、△H2>△H1>△H3 |
考点:反应热的大小比较
专题:化学反应中的能量变化
分析:根据稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.
解答:
解:因强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O△H=-57.3kJ/mol,
分别向1L 0.5mol/L的NaOH溶液中加入:①稀盐酸;②浓H2SO4;③稀醋酸,因醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>①>③,所以△H3>△H1>△H2,
故选B.
分别向1L 0.5mol/L的NaOH溶液中加入:①稀盐酸;②浓H2SO4;③稀醋酸,因醋酸的电离吸热,浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>①>③,所以△H3>△H1>△H2,
故选B.
点评:本题考查中和热,明确中和热的概念及弱电解质的电离、浓硫酸溶于水的热效应即可解答,需要注意的是放出的能量多,△H反而小.

练习册系列答案
相关题目
下列说法正确的是( )
| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、二氧化硫可用于消毒杀菌和漂白纸张草帽等 |
| C、过氧化钠、烧碱、纯碱分别属于碱性氧化物、碱、盐 |
| D、Na、Al、Cu可以分别用热还原法、热分解法和电解冶炼法得到 |
下列说法不正确的是( )
| A、水晶、玛瑙、光导纤维这些物质的主要成分是SiO2 |
| B、SiO2为酸性氧化物,能与强碱反应,但不能与酸反应 |
| C、装NaOH的试剂瓶不能用玻璃塞,因为SiO2与NaOH反应生成的Na2SiO3具有粘性 |
| D、计算机芯片CPU主要成分是单晶硅 |
影响一定量气体体积的主要因素是( )
| A、微粒间的平均距离 |
| B、微粒本身的大小 |
| C、微粒的质量 |
| D、气体分子的微粒数 |
在密闭容器中发生如下反应:mA(气)+nB(气)?pC(气)达到平衡后,温度一定时,将气体体积压缩到原来的
,当达到平衡时,C的浓度的为原来的1.9倍,若压缩时温度不变,则下列说法中不正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率降低 |
| C、平衡向逆反应方向移动 |
| D、C的体积百分含量增加 |
下列化学用语书写不正确的是( )
A、甲烷的电子式: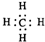 | ||
B、氟化钠的电子式: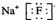 | ||
| C、硫离子的电子式:S2- | ||
D、碳-12原子:
|
硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se) 的保健品已经进入市场,已知它与氧元素同族,与 K 同周期,关于硒的说法中不正确的是( )
| A、原子序数为20 |
| B、最高价氧化物的水化物的分子式为:H2SeO4 |
| C、Se的非金属性比Br弱 |
| D、气态氢化物的稳定性比硫化氢气体强 |
微量元素硒(Se)对人体有保健作用,已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,下列对硒元素性质的描述不正确的是( )
| A、硒化氢不稳定 |
| B、最高氧化物的化学式是SeO3 |
| C、硒与铁反应可生成FeSe |
| D、酸性强弱顺序:H2SeO4>H2SO4 |
检验氯化氢气体中是否混有Cl2可采用的方法是( )
| A、用湿润的蓝色石蕊试纸 |
| B、用干燥有色布条 |
| C、用湿润的淀粉碘化钾试纸 |
| D、将气体通入硝酸银溶液 |