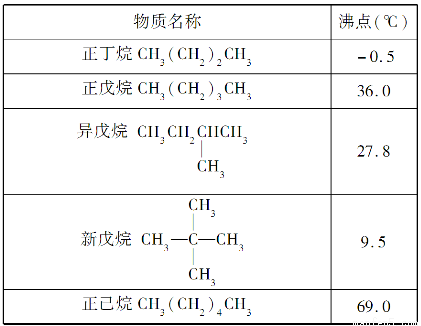
题目内容
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片上________
(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来,组成一个原电池,负极为______,正极的电极反应式为___________。
(2)如果烧杯中最初装入的是500mL 2 mol·L-1的稀硫酸,构成铜锌原电池(假设产生的气体没有损失),当在标准状况下收集到11.2 L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)________________________。
(1)没有 锌片 2H++2e-=H2↑
(2)c(H2SO4)=1 mol·L-1,c(ZnSO4)=1 mol·L-1
【解析】铜片插入稀硫酸中时,二者不反应,没有气泡产生,但当把铜片和锌片用导线相连插入稀硫酸中时,会构成原电池,铜作为原电池正极,电极反应为2H++2e-=H2↑,锌作为原电池负极,电极反应为Zn-2e-=Zn2+,电池总反应为Zn+2H+=Zn2++H2↑。当收集到11.2L H2(标准状况),即0.5 mol H2时,消耗的H2SO4为0.5mol,生成的ZnSO4为0.5mol,c(H2SO4)=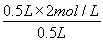 =1 mol·L-1,c(ZnSO4)=
=1 mol·L-1,c(ZnSO4)=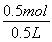 =1 mol·L-1。
=1 mol·L-1。

练习册系列答案
相关题目