题目内容
用石墨作电极电解1000mL 0.1mol/L CuSO4溶液,通电一段时间后关闭电源,测得溶液的质量减少了9.8g.下列有关叙述正确的是(NA代表阿伏加德罗常数)( )
分析:A、根据溶液的质量减少情况确定两极的放电情况进而确定转移的电子数目;
B、根据转移电子的数目可以确定两极上产生的气体的物质的量;
C、根据电解以后溶液的组成来计算溶液的pH;
D、根据电解过程,本着“出啥加啥”的思想来确定要加入的物质以及加入的量.
B、根据转移电子的数目可以确定两极上产生的气体的物质的量;
C、根据电解以后溶液的组成来计算溶液的pH;
D、根据电解过程,本着“出啥加啥”的思想来确定要加入的物质以及加入的量.
解答:解:A用石墨作电极电解1000mL 0.1mol/L CuSO4溶液的阴极反应首先是Cu2++2e-=Cu,假设所有的铜离子0.1mol全部放电,转移电子的物质的量为0.2mol,则析出金属铜的质量为:0.1mol×64g/mol=6.4g,此时阳极放电的电极反应为:4OH-=O2↑+H2O+4e-,转移0.2mol电子时生成的氧气的质量是:0.05mol×32g/mol=1.6g,所以溶液质量减少总量为6.4g+1.6g=8g<9.8g,接下来阴极放电的是氢离子,阳极仍是氢氧根放电,相当于此阶段电解水,还要电解掉水的质量为9.8g-8g=1.8g,电解掉这些水转移电子的物质的量为0.2mol,所以整个过程转移电子的总量为0.4mol,个数为0.4NA,故A错误;
B、阳极放电的电极反应为:4OH-=O2↑+H2O+4e-,当转移0.4mol电子时,产生的氧气物质的量为0.1mol,即2.24L,阴极上产生氢气,2H++2e-=H2↑,当转移0.2mol电子时,产生的氢气物质的量为0.1mol,即2.24L,所以在标准状况下,两极共产生4.48L气体,故B正确;
C、电解过程中溶液中的氢离子减少了0.2mol,而氢氧根总共减少了0.4mol,所以最后溶液中c(H+)=
=0.2mol/l,其pH<1,故C错误;
D、溶液相当于减少了氧化铜和水,需加入的氧化铜质量为0.1mol,即8g,还需加入1.8g的水才能复原,故D错误.
故选B.
B、阳极放电的电极反应为:4OH-=O2↑+H2O+4e-,当转移0.4mol电子时,产生的氧气物质的量为0.1mol,即2.24L,阴极上产生氢气,2H++2e-=H2↑,当转移0.2mol电子时,产生的氢气物质的量为0.1mol,即2.24L,所以在标准状况下,两极共产生4.48L气体,故B正确;
C、电解过程中溶液中的氢离子减少了0.2mol,而氢氧根总共减少了0.4mol,所以最后溶液中c(H+)=
| 0.2mol |
| 1L |
D、溶液相当于减少了氧化铜和水,需加入的氧化铜质量为0.1mol,即8g,还需加入1.8g的水才能复原,故D错误.
故选B.
点评:本题是一道考查电解原理的综合题,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
|
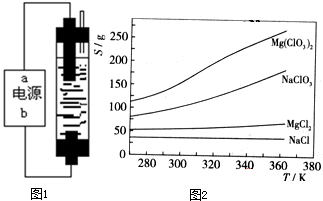
据中新网宁波 2009年8月10日电,受台风“莫拉克”袭击,浙江省奉化市遭受史上罕见特大山洪,共造成三人死亡一人失踪,受灾的农村地区饮用的水井普遍遭遇病毒、细菌等不同程度的污染,当地各级政府下派专业人员使用消毒液实施消毒.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液.通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图所示的装置,则下列对电源电极名称和消毒液的主要成分判断正确的是
| |
| [ ] | |
A. |
a为正极,b为负极;NaClO和NaCl |
B. |
a为负极,b为正极;NaClO和NaCl |
C. |
a为阳极,b为阴极;HClO和NaCl |
D. |
a为阴极,b为阳极;HClO和NaCl |
 CO32-+ H3O+
CO32-+ H3O+ H2S↑+2OH-
H2S↑+2OH- Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-