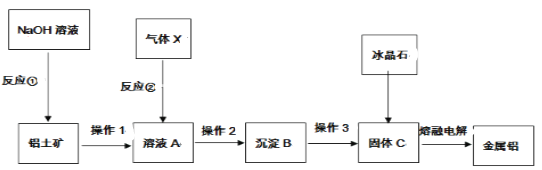
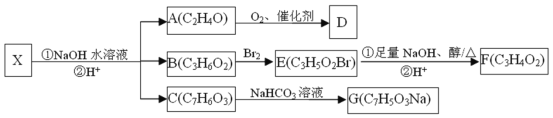
题目内容
【题目】实验题。实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
硫酸 化学纯(CP)
(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为________(填序号)。
(2)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制240 mL 0.1 mol·L-1的稀硫酸,需取该浓硫酸________ mL,计算所需浓硫酸的体积用到的公式___________。
(3)接下来完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、___________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是_________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为________。
(5)下列操作会使所配溶液浓度偏高的是____(填字母)。
A 转移溶液时未洗涤烧杯
B 定容时俯视容量瓶的刻度线
C 容量瓶用蒸馏水洗净后仍残留有蒸馏水
D 用量筒量取浓硫酸,读数时仰视刻度线
【答案】②①③⑤⑥④⑦ 1.4 c(浓)V(浓)= c(稀)V(稀) 250mL的容量瓶、胶头滴管 0.1mol/LH2SO4(aq) 0.05mol/L BD
【解析】
(1)配制溶液时,一般按计算、量取、溶解、转移、洗涤、定容、装瓶等顺序操作。
(2)要配制240 mL 0.1 mol·L-1的稀硫酸,应选择250mL的容量瓶,利用稀释前后溶质的物质的量不变进行计算。
(3)完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、250mL的容量瓶、胶头滴管。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容应体现浓度和溶质;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度仍按稀释前后溶质的物质的量不变进行计算。
(5)A. 转移溶液时未洗涤烧杯,则有一部分溶质留在烧杯内壁上;
B. 定容时俯视容量瓶的刻度线,导致所配溶液的液面低于刻度线;
C. 容量瓶用蒸馏水洗净后仍残留有蒸馏水,对最终所配溶液的体积不产生影响;
D. 用量筒量取浓硫酸,读数时仰视刻度线,导致液面高于刻度线。
(1)配制溶液时,一般按计算、量取、溶解、转移、洗涤、定容、装瓶等顺序操作,则其正确的操作顺序为②①③⑤⑥④⑦;
答案为:②①③⑤⑥④⑦;
(2)要配制240 mL 0.1 mol·L-1的稀硫酸,应选择250mL的容量瓶;浓硫酸的物质的浓度为![]() =18.4mol/L,利用公式c(浓)V(浓)= c(稀)V(稀),带入数值可以求出V(浓)=
=18.4mol/L,利用公式c(浓)V(浓)= c(稀)V(稀),带入数值可以求出V(浓)=![]() =1.4mL;
=1.4mL;
答案为:1.4;c(浓)V(浓)= c(稀)V(稀);
(3)完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、250mL的容量瓶、胶头滴管;
答案为:250mL的容量瓶、胶头滴管;
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容为0.1mol/LH2SO4(aq);若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为0.05mol/L;
答案为:0.1mol/LH2SO4(aq);0.05mol/L;
(5)A. 转移溶液时未洗涤烧杯,则有一部分溶质留在烧杯内壁上,从而使得所配溶液的浓度偏低,A不合题意;
B. 定容时俯视容量瓶的刻度线,导致所配溶液的液面低于刻度线,溶液的体积偏小,所配溶液的浓度偏高,B符合题意;
C. 容量瓶用蒸馏水洗净后仍残留有蒸馏水,溶液体积不变,所配溶液的浓度不变,C不合题意;
D. 用量筒量取浓硫酸,读数时仰视刻度线,导致量取浓硫酸的体积偏大,浓度偏高,D符合题意;
答案为:BD。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
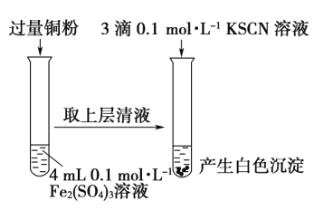
实验Ⅰ:将![]() 转化为
转化为![]()
查阅资料:
已知:①![]() 的化学性质与
的化学性质与![]() 相似
相似
②![]()
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
查阅资料:![]() (棕色)
(棕色)
下列说法不正确的是
A.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
B.取![]() 溶液,向其中滴加3滴
溶液,向其中滴加3滴![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
C.![]() 与
与![]() 反应的离子方程式为
反应的离子方程式为![]()
D.产生![]() 的原因:
的原因:![]()