题目内容
铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3 D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体, 该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。
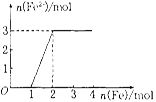
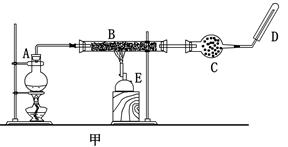
(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+? ___________________________________________________________。

回答下列有关问题:
(1)铁元素在周期表中的位置是___________________________。
(2)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是________(选填序号)。
A.Cl2 B.Fe C.HNO3 D.H2O2
(3)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价),下列说法正确的是________(选填序号)。
A.从物质分类的角度看,黄铜矿属于合金
B.反应中,所有铁元素均被还原
C.反应中,CuFeS2既作氧化剂又作还原剂
D.当转移1 mol电子时,46 g CuFeS2参加反应
(4)下述反应中,若FeSO4和O2的系数比为2︰1,试配平下列方程式:
FeSO4 + K2O2 → K2FeO4 + K2O + K2SO4 + O2↑
(5)向某稀HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体, 该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如右图所示。则混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为__________。
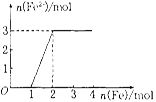
(6)某同学将铁与水蒸气高温反应后的固体物质溶解在过量盐酸中,如何判断所得溶液中是否含有Fe3+? ___________________________________________________________。
(1)第四周期第Ⅷ族(2)D(3)D(4)2 6 2 2 2 1
(5)4∶1(6)取少量溶液于试管中,加入2~3滴KSCN溶液,如溶液呈血红色,则有Fe3+,反之则无。(其他合理答案均可,但不适用NaOH)
(5)4∶1(6)取少量溶液于试管中,加入2~3滴KSCN溶液,如溶液呈血红色,则有Fe3+,反之则无。(其他合理答案均可,但不适用NaOH)
试题分析:(1)铁元素在周期表中的位置是第四周期第Ⅷ族。
(2)要实现转化①Fe2+转化为Fe3+需要加氧化剂才能实现,要使产物纯净,必须所加试剂发生反应后,不引进杂质;A、氯气具有氧化性,能将Fe2+氧化生成Fe3+,但同时有氯离子生成,引进了杂质离子,错误;B、铁不能把二价铁离子转化为三价铁离子,错误;C、硝酸能将Fe2+氧化生成Fe3+,但溶液中会引进杂质硝酸根离子,错误;D、双氧水能将Fe2+氧化生成Fe3+,产物为水,不引进杂质,正确。
(3)A、合金是由两种或两种以上的金属或金属与非金属熔合在一起形成的具有金属特性的物质,黄铜矿不是合金,错误;B、CuFeS2中铁元素的化合价为+2价,反应物Fe3+的化合价为+3价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,错误;C、CuFeS2中只有S元素的化合价升高,其他元素的化合价不变,所以CuFeS2只作还原剂,错误;D、该反应中硫元素的化合价由-2价升高到0价(2个硫原子变价),铁元素的化合价由+3价降低到+2价(4个铁变价),故1mol CuFeS2参加反应转移4mol电子,46 g CuFeS2的物质的量为0.25mol,参加反应转移的电子为1mol,正确。
(4)结合题给信息利用化合价升降法配平,化学方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+O2↑,答案为:2、6、2、2、2、1;
(5)稀溶液中HNO3和Fe(NO3)3的氧化性顺序为HNO3>Fe(NO3)3,加入铁后会依次发生氧化还原反应,①Fe+4HNO3= Fe(NO3)3+NO↑+2H2O;②Fe+2Fe3+=3Fe2+;从图象中可知铁为1mol时,无Fe2+生成,发生反应①消耗硝酸为4mol,生成Fe3+1mol;再加入1mol铁发生反应②生成Fe2+物质的量为3mol,反应的Fe3+物质的量为2mol,其中原溶液中的Fe3+物质的量1mol;混合溶液中HNO3和Fe(NO3)3的物质的量浓度之比为4:1。
(6)考查Fe3+的检验方法,答案为:取少量溶液于试管中,加入2~3滴KSCN溶液,如溶液呈血红色,则有Fe3+,反之则无Fe3+。

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目

 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验: 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是