题目内容
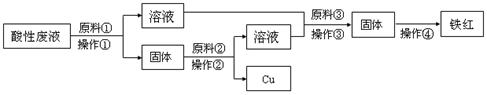
(6分) 刻制印刷电路板得到的酸性废液中含有大量的FeCl2、CuCl2、FeCl3。为了减少污染并变废为宝,工程师们设计了如下流程,以常用的酸、碱和废铁屑为原料回收铜和制备铁红(Fe2O3)。
请回答
(1)原料③的焰色反应呈黄色,其化学式为_ ___。
(2)加入原料①后发生的离子反应中,不属于置换反应的离子方程式为
_ ___。
(3)若在实验室中完成操作②,其步骤包括搅拌和__ __,需要用到的玻璃仪器有
___ _(填字母)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯

请回答
(1)原料③的焰色反应呈黄色,其化学式为_ ___。
(2)加入原料①后发生的离子反应中,不属于置换反应的离子方程式为
_ ___。
(3)若在实验室中完成操作②,其步骤包括搅拌和__ __,需要用到的玻璃仪器有
___ _(填字母)。
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(1)NaOH (2)2Fe3+ + Fe = 3Fe2+ (3)过滤 abc
试题分析:(1)钠元素的焰色反应是显黄色的,所以原料③是氢氧化钠。
(2)由于要除去铜离子和亚铁离子,所以原料①是铁,因此不属于置换反应的离子方程式是2Fe3+ + Fe = 3Fe2+。
(3)铜是固体不溶于水,过滤即可得到。过滤需要的仪器是烧杯、漏斗和玻璃棒,答案选abc。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。

练习册系列答案
相关题目