题目内容
【题目】燃煤的烟气中常含有大量的NOx、CO、SO2等有害气体,治理污染、消除有害气体对环境的影响是化学工作者研究的重要课题。
Ⅰ.已知氮氧化物可采用强氧化剂Na2S2O8氧化脱除,过程如下所示:
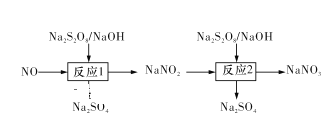
(1)写出反应1的离子方程式:____ 。
(2)反应2为NO2-+S2O82-+2OH-=NO3-+2SO42-+H2O。此反应在不同温度下达到平衡时,NO2-的脱除率与Na2S2O8初始浓度的关系如图1所示。
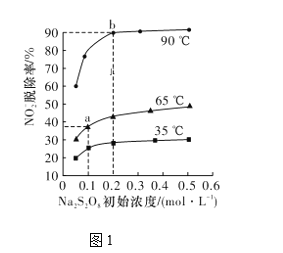
①比较a、b点的反应速率:va正____vb逆(填“>”“<”或“=”)。
②根据图像可以判断该反应为吸热反应,理由是____________。
Ⅱ.沥青混凝土可作为反应2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
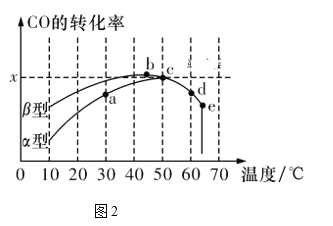
(3)下列关于图2的说法正确的是________。
A.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
B.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
C.a、b、c、d四点中,达到平衡状态的只有b、c两点
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(4)已知c点时容器中O2浓度为0.02 mol/L,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=_____________(用含x的代数式表示)。
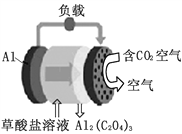
Ⅲ.利用图3所示装置(电极均为惰性电极)可吸收SO2。
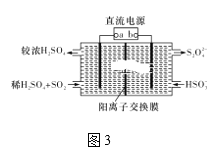
(5)直流电源b极为____,阳极发生的反应为______。
【答案】2NO+S2O82-+4OH-===2NO2-+2SO42-+2H2O < 当Na2S2O8初始浓度相同时,温度越高,NO![]() 脱除率越大,说明平衡正向移动,该反应为吸热反应 AD
脱除率越大,说明平衡正向移动,该反应为吸热反应 AD ![]() mol/L 负极 SO2-2e-+2H2O===SO42-+4H+
mol/L 负极 SO2-2e-+2H2O===SO42-+4H+
【解析】
根据题意可知,本题考查化学平衡的影响因素及化学平衡的计算,运用勒夏特列原理进行分析。
(1)反应1是Na2S2O8的氢氧化钠溶液中通入NO气体发生氧化还原反应生成硫酸钠、亚硝酸钠和水, 反应的离子方程式为:2NO+S2O82-+4OH-===2NO2-+2SO42-+2H2O,
故答案为:2NO+S2O82-+4OH-===2NO2-+2SO42-+2H2O;
(2)温度越高NO脱除率越大,说明升温反应速率增大,a、b点的反应速率va正< vb逆,
故答案为:<;
(3)升温平衡向吸热方向移动,而当Na2S2O8初始浓度相同时,温度越高,NO![]() 脱除率越大,说明平衡正向进行,正反应为吸热反应,
脱除率越大,说明平衡正向进行,正反应为吸热反应,
故答案为:当Na2S2O8初始浓度相同时,温度越高,NO![]() 脱除率越大,说明平衡正向移动,该反应为吸热;
脱除率越大,说明平衡正向移动,该反应为吸热;
(3)A. 由图得,相同温度下β型沥青混凝土中CO降解速率比α型要大,故A正确;
B. a点的数据反映出CO降解率是整个实验过程中最高的,故B错误;
C. 图象分析可知b点反应达到平衡状态,升温平衡逆向进行,a、b、c、d 四点中,达到平衡状态的是bcd, 故C错误;
D. e点降解率出现突变的原因可能是温度升高后催化剂失去活性失效,故D正确;
故答案为:AD;
(4)令起始时CO的浓度为1mol·L-1,则达到平衡时c(CO)=(1-x)mol/L,c(O2)=0.02mol/L,c(CO2)=xmol/L,根据平衡常数的定义,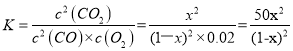
故答案为:![]() ;
;
(5)由装置图可知SO2在左边发生氧化反应生成SO42-,电极反应方程式为:SO2-2e-+2H2O===SO42-+4H+,因此a所连的电极为电解池的阳极,而电解池的阳极连接的是电源的正极,因此a为电源正极,b为电源负极,
故答案为:负极;SO2-2e-+2H2O===SO42-+4H+。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案