题目内容
6.反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示正确的是( )| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应速率,其比值是3:2:1 | |
| C. | 在2min末的反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 在2min内的反应速率,用C表示是0.3 mol•L-1•min-1 |
分析 经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,
A.化学反应速率表示单位时间内浓度的变化量,固体或纯液体的浓度一般视为常数,一般也不用固体或纯液体来表示反应速;
B.不同物质表示的速率之比等于其化学计量数之比;
C.化学反应速率为一段时间内平均速率,不是即时速率;
D.浓度变化量之比等于其化学计量数之比,据此计算△c(C),再根据v=$\frac{△c}{△t}$计算v(C).
解答 解:经2min,B的浓度减少0.6mol/L,v(B)=$\frac{0.6mol/L}{2min}$=0.3mol•(L•min)-1,
A.A物质为纯固体,浓度不变,不能表示反应速率,故A错误;
B.反应速率之比等于化学计量数之比,则分别用B、C、D表示的反应速率其比值是3:2:1,故B正确;
C.2min末的反应速率为即时速率,则在2min内的反应速率,用B表示是0.3 mol•(L•min)-1,是2min内的平均速率,故C错误;
D.2min内△c(C)=$\frac{2}{3}$△c(B)=0.4mol/L,故2min内的v(C)=$\frac{0.4mol/L}{2min}$=0.2mol•L-1•min-1,故D错误;
故选B.
点评 本题考查化学反应速率的计算及与化学计量数的关系,明确计算公式及反应速率为平均速率即可解答,注意选项A为易错点,题目难度不大.

练习册系列答案
相关题目
16.下列有关化学用语使用正确的是( )
| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}O$ | |
| D. | Cr原子的电子排布式:[Ar]3d44s2 |
17.提高能源的利用率已成为国际能源研究的热点课题.下列相关措施使用不当的是( )
| A. | 使燃料充分燃烧 | B. | 合理使用能源 | ||
| C. | 加强能源利用的科技投入 | D. | 加大能源开采力度 |
14.下列化学用语正确的是( )
| A. | 羟基的电子式: | B. | 聚丙烯的结构简式: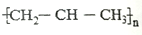 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 苯甲酸的结构简式: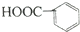 |
11.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 碱性氧化物--氧化铁--FeO | B. | 酸性氧化物--碳酸--C0 | ||
| C. | 酸--硫酸--H2S | D. | 盐--纯碱--Na2CO3 |
18.钢铁发生吸氧腐蚀时,发生还原反应的电极反应式是( )
| A. | Fe→Fe2++2e- | B. | 2H++2e-→H2↑ | ||
| C. | 4OH-→2H2O+O2↑+4e- | D. | 2H2O+O2+4e-→4OH- |
15.不经处理即可排放的工业废气是为( )
| A. | 接触法制硫酸的尾气 | B. | 氯碱工业尾气 | ||
| C. | 高炉煤气 | D. | 煅烧石灰石产生的气体 |
16.在pH=1的溶液中,因发生氧化还原反应而不能大量共存的离子组是( )
| A. | Ca2+、Cl-、HCO3-、K+ | B. | ClO-、K+、SO42-、Ba2+ | ||
| C. | CH3COO-、K+、Na+、CO32- | D. | Fe2+、Ag+、NO3-、K+ |
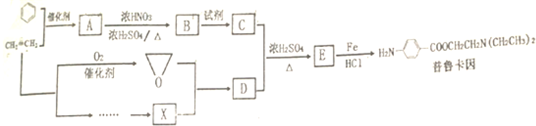
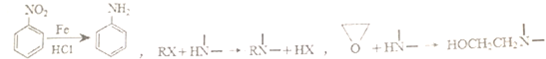
 .
.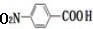 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.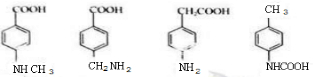 .
.