题目内容
下图为物质A~I的转化关系(部分反应物、生成物没有列出)。其中B为某金属矿的主要成分,经过一系列反应可得到E和F。D、E常温下为气体,D、F为常见单质,单质F可与H的浓溶液加热时发生反应。
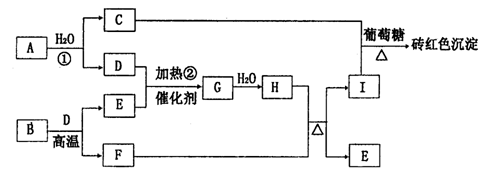
请回答下列问题:
(1)写出G的化学式:________________。
(2)反应①的离子方程式为__________________。
(3)单质F与H的浓溶液发生反应的化学方程式为______________________。
(4)用Pt作电极电解I溶液,完全电解后的电解质溶液是_______________,其阳极的电极反应式为____________________。
(5)已知每16gE与D完全反应,放出24.75 kJ热量,则反应②的热化学方程式为
________________________________________________.
(6)工业制备G时,混合气体的组成中E占7%、D占11%,现有100体积混合气体进入反应装置,导出的气体恢复到原温度和压强后变为97.2体积。则E的转化率为________.
(1) SO3 (2分)
(2) 2Na2O2+2H2O═4Na+ + 4OH- + O2↑ (2分)
(3) Cu + 2H2SO4 (浓) ![]() CuSO4 + SO2↑ + 2H2O (2分)
CuSO4 + SO2↑ + 2H2O (2分)
(4) H2SO4 (2分) 4OH-→2H2O + O2↑+4e- (2分)
(5)2SO2(2分)+ O2(g)![]() 2SO3(2分) △H = -198 kJ·mol-1 (2分)
2SO3(2分) △H = -198 kJ·mol-1 (2分)
(6)80% (2分)
解析:
略

练习册系列答案
相关题目
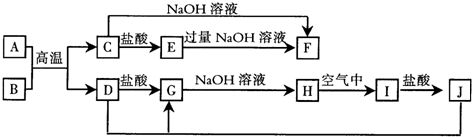
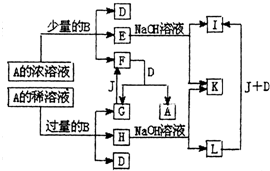 A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色.A~L各物质之间相互反应转化关系如下图所示,请回答:
A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色.A~L各物质之间相互反应转化关系如下图所示,请回答: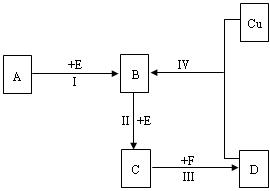
 ,则:
,则: