题目内容
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1)在O〜30小时内,CH4的平均生成速率和
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热分别为
和
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
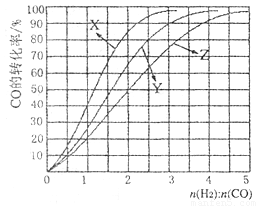
(4)工业上常利用反应CO(g)+2H2(g) CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
①2700C的实验结果所对应的曲线是_________(填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________(填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(10分)(1)v(Ⅰ) > v(Ⅱ) > v(Ⅲ) (1分) II (1分)
(2)28 (mol·L-1)2(2分,不带单位不扣分,得出27同样得分)
(3)CH3OH (l) + O2(g)= CO(g) + 2H2O(l) △H=-443.5 kJ·mol-1(2分)
(4) ① Z (1分) ② B (1分)
(5)CH3OH-6e-+8OH- = CO32-+6H2O(2分)
解析:本题考查化学反应速率的概念、计算及外界条件对反应速率对影响;反应热的概念和盖斯定律的计算;热化学方程式的书写;与化学平衡有关的计算;图像的识别和绘制。
(1)由图像可以看出,反应进行到30小时时,催化剂Ⅲ生成的甲烷最多,其次是催化剂Ⅱ,催化剂Ⅰ生成的甲烷最少。因此VI、VII和VIII从大到小的顺序为VIII>VII>VI>;同理由图像也可以看出,反应进行到12小时时,催化剂Ⅱ生成的甲烷最多,因此在第Ⅱ种催化剂的作用下,收集的CH4最多。
(2)设CH4、H2O的物质的量均为xmol,则
CH4(g) + H2O(g)CO(g)+3H2(g)
起始量(mol) x x 0 0
变化量(mol)O.10 O.10 O.10 O.30
平衡量(mol) x-O.10 x- O.10 O.10 O.30
根据题意,转化率为91%,则91%x=0.1则x=0.11,平衡各物质的浓度分别为0.01mol·L-1、0.01mol·L-1、O.10 mol·L-1、O.30 mol·L-1,则平衡常数K=c(CO)·c3(H2)/[c(CH4)·c(H2O)]=0.01 mol·L-1·(O.30 mol·L-1)3/[(O.10 mol·L-1)·( O.10 mol·L-1)]=27(mol·L-1)2
(3)由热化学方程式①CO(g)+ 1/2O2(g)= CO2(g) △H=-283 kJ•mol-1
②CH3OH(g)+3/2O2(g) ==CO2(g)+2H2O(l) △H=-726.5kJ•mol-1
②-①得CH3OH (l) + O2(g) = CO(g) + 2H2O(l) △H=-443.5 kJ·mol-1
(4)①由于合成甲醇的反应是放热反应,温度升高,平衡向逆反应方向移动,CO的转化率降低,故2700C的实验结果所对应的曲线是Z;②从图像中2300C对应X曲线,n(H2):n(CO)的比值达到2.5——3范围,CO的转化率才达到最大,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围选B。
(5)甲醇燃料电池的负极为甲醇被氧化,生成CO32-,故电极反应式为CH3OH-6e-+8OH- = CO32-+6H2O。

 阅读快车系列答案
阅读快车系列答案
 和
和 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。 CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。 分别为
分别为 和
和 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。

 和
和 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。 CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。 分别为
分别为 和
和 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。