题目内容
现有25 mL 2 mol·L-1 Na2CO3和75 mL 1 mol·L-1的稀盐酸:①将Na2CO3溶液缓缓滴到稀盐酸中;②将稀盐酸缓缓滴到Na2CO3溶液中,在标准状况下产生气体的体积情况是( )。
| A.均为0.84 L | B.均为0.56 L |
| C.①>② | D.②>① |
C
①将Na2CO3溶液逐滴加入到盐酸中,开始时,HCl过量,有关反应为:
Na2CO3+ 2HCl=2NaCl+CO2↑+H2O
1 mol 2 mol 22.4 L
0.05 mol 0.075 mol V1
生成CO2的体积用HCl的量计算:
V1=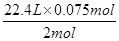 =0.84 L
=0.84 L
②将盐酸逐滴加入到Na2CO3溶液中,开始时,Na2CO3过量,反应分两步进行:
Na2CO3+ HCl = NaHCO3+NaCl
1 mol 1 mol 1 mol
0.05 mol 0.05 mol 0.05 mol
NaHCO3+ HCl=NaCl+H2O+CO2↑
1 mol 1 mol 22.4 L
0.05 mol (0.075-0.05)mol V2
生成的CO2用剩余HCl的量计算:
V2=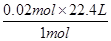 =0.56 L,所以V1>V2。
=0.56 L,所以V1>V2。
Na2CO3+ 2HCl=2NaCl+CO2↑+H2O
1 mol 2 mol 22.4 L
0.05 mol 0.075 mol V1
生成CO2的体积用HCl的量计算:
V1=
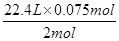 =0.84 L
=0.84 L②将盐酸逐滴加入到Na2CO3溶液中,开始时,Na2CO3过量,反应分两步进行:
Na2CO3+ HCl = NaHCO3+NaCl
1 mol 1 mol 1 mol
0.05 mol 0.05 mol 0.05 mol
NaHCO3+ HCl=NaCl+H2O+CO2↑
1 mol 1 mol 22.4 L
0.05 mol (0.075-0.05)mol V2
生成的CO2用剩余HCl的量计算:
V2=
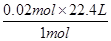 =0.56 L,所以V1>V2。
=0.56 L,所以V1>V2。
练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目