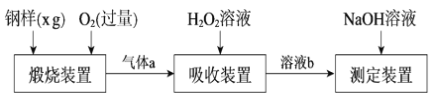
题目内容
【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:

①、③均观察到实验现象:溶液呈蓝色,试管口有红棕色气体产生。下列说法正确的是
A. ①试管口有红棕色气体产生,原因是硝酸被还原为NO2
B. 由③的现象可得出结论:Cu可与稀硫酸反应
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ === 3Cu2++2NO↑+4H2O
D. ③中可能产生SO2
【答案】C
【解析】
A. 稀硝酸和铜片反应的离子方程式为:3Cu+2NO3-+8H+ = 3Cu2++2NO↑+4H2O,①试管口有红棕色气体产生是因为NO被氧化为NO2,故A错误;
B. 产生③的现象是因为剩余的NO3-遇到硫酸中的氢离子发生了反应:3Cu+2NO3-+8H+ = 3Cu2++2NO↑+4H2O,故B错误;
C. ③中反应的离子方程式:3Cu+2NO3-+8H+ = 3Cu2++2NO↑+4H2O,故C正确;
D. SO2具有较强的还原性,所以③中不可能产生SO2,故D错误;答案:C。

练习册系列答案
相关题目