题目内容
【题目】某同学运用电解原理实现在铁棒上镀铜,设计如图装置,下列判断不正确是

A.a 是铁B.液体 c 可用硫酸铜溶液
C.该实验过程中c Cu2+变小D.b 上发生反应的方程式为 Cu-2e-= Cu2+
【答案】C
【解析】
要在铁棒上镀铜,则铁电极应发生还原反应生成铜单质,即铁电极为阴极,与负极相连,则b电极为阳极,发生氧化反应,要在铁电极生成铜单质,则溶液应为含铜的盐。
A. a为铁,发生还原反应生成铜,达到镀铜的目的,故A正确;
B.电解质应含铜离子,可为硫酸铜等,故B正确;
C.电镀时,阳极消耗铜,阴极析出铜,c(Cu2+)基本保持不变,故C不正确;
D. b发生氧化反应,为Cu- 2e-= Cu2+,故D正确;
故选:C。

练习册系列答案
相关题目
【题目】已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
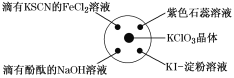
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变成蓝色 | Cl2具有氧化性 |
A.AB.BC.CD.D
