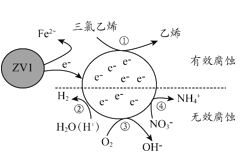
题目内容
【题目】如图设计的串联电池装置,R为变阻器,以调节电路电流。
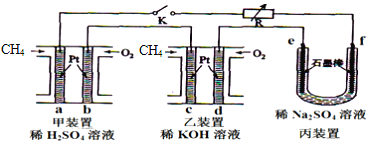
(1)写出b、c电极的电极反应式:b___,c___;
(2)写出f电极的电极反应式___,向此电极区域滴入酚酞的现象为:___;该电极区域水的电离平衡被___(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH___(填“变大”、“变小”或“不变”),原因是___。
(4)电解一段时间后丙装置析出芒硝(Na2SO410H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___gH2O就可以将析出的沉淀溶解并恢复到原有浓度。
(5)有一硝酸盐晶体,其化学式为M(NO3)xyH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为___;
②电解后,生成气体体积=___(标准状况下)溶液的pH=___(电解过程中溶液体积变化忽略不计)。要求写出计算过程。
【答案】O2+4H++4e-=2H2O CH4+10OH-﹣8e-=CO32-+7H2O 2H++2e-=H2↑ 溶液变红 促进 不变 硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变 72 64 0.056L 1
【解析】
(1)~(4)根据图示,甲乙装置为两个燃料电池串联,丙为电解硫酸钠的装置。甲乙装置中通入甲烷的电极为负极,即a、c为负极,通入氧气的为正极,即b、d为正极,则e为阳极,f为阴极,由此分析解答;
(5)依据题干信息可知A电极析出金属,所以A电极是电解池的阴极,B是电解池的阳极,与电极相连的电源C为负极,D为正极;依据电子守恒和电极反应计算得到;依据电解方程式根据M的物质的量求出氢离子的物质的量,然后求pH。
(1)根据上述分析,b为正极,发生还原反应,电解质为硫酸,电极反应式为O2+4H++4e-=2H2O,c电极为负极,发生氧化反应,电解质为氢氧化钾,电极反应式为CH4+10OH--8e-=CO32-+7H2O;
(2)f电极为阴极,发生还原反应,电极反应式为2H++2e-=H2↑,电解反应发生后,电极附近溶液显碱性,向此电极区域滴入酚酞,溶液变红色;氢离子浓度减小,该电极区域水的电离平衡受到促进;
(3)丙装置为电解硫酸钠溶液,相当于电解水,电解后电解质溶液pH不变;
(4)CH4的体积为22.4L(标准状况下),甲烷的物质的量为1mol,根据CH4+10OH--8e-=CO32-+7H2O可知,转移的电子为8mol,则丙装置中电解的水为4mol,质量为4mol×18g/mol=72g,因此需要加入72g水,可以将析出的沉淀溶解并恢复到原有浓度;
(5)有一硝酸盐晶体,其化学式表示为M(NO3)xnH2O经测定其摩尔质量为242gmol-1;取1.21g该晶体物质的量=![]() =0.005mol;溶于水配成100mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,A极为阴极;析出的金属电极反应为:Mx++xe-═M,则金属M的摩尔质量为
=0.005mol;溶于水配成100mL溶液,将此溶液倒入如图所示装置中,用石墨作电极进行电解,当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g,A极为阴极;析出的金属电极反应为:Mx++xe-═M,则金属M的摩尔质量为![]() =64g/mol,故金属M的相对原子质量为64;
=64g/mol,故金属M的相对原子质量为64;
②阳极连接电源的正极,溶液中氢氧根离子失电子生成氧气;阴极连接电源的负极,溶液中M离子得到电子生成金属M,阳极电极反应为4OH--4e-=O2↑+2H2O,转移电子0.01mol时,生成氧气的体积为![]() ×22.4L/mol=0.056L;金属M的相对原子质量为64,则金属为Cu,此时溶液中电解离子方程式为:2Cu2++2H2O
×22.4L/mol=0.056L;金属M的相对原子质量为64,则金属为Cu,此时溶液中电解离子方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+,已知电解生成Cu的物质的量为0.005mol,则n(H+)=2n(Cu)=0.01mol,此时c(H+)=
2Cu+O2↑+4H+,已知电解生成Cu的物质的量为0.005mol,则n(H+)=2n(Cu)=0.01mol,此时c(H+)=![]() =0.1mol/L,故电解后溶液pH=1。
=0.1mol/L,故电解后溶液pH=1。

 阅读快车系列答案
阅读快车系列答案【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
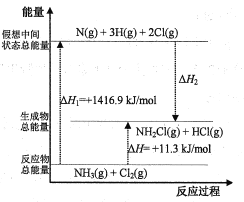
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
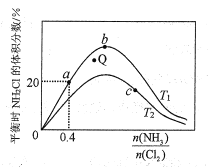
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯

乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。