题目内容
今有两种金属的混合物A.铁和锌 B.镁和铜
C.铝和镁 D.锌和铁
B
解析:方法(1)—平均相对分子质量M
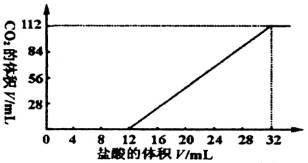
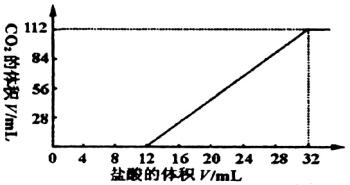
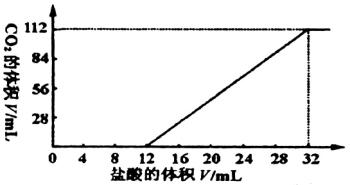
分析:设金属为+2价,则 X+2HCl![]() XCl2+H2↑
XCl2+H2↑
平均相对分子质量 ![]() g
g
M=
B中:相对分子质量Mg<41.6,Cu不反应 符合
C中:相对分子质量Mg<41.6,Al<41.6 不符合
D中:相对分子质量Zn>41.6,Fe>41.6不符合
方法(2)—平均电子摩尔质量—转移1 mol电子消耗金属的平均质量
因得到H
A中:转移1 mol电子消耗金属的质量Ca>
B中:转移1 mol电子消耗金属的质量Mg<
C中:转移1 mol电子消耗金属的质量Mg<
D中:转移1 mol电子消耗金属的质量Zn>

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目