��Ŀ����
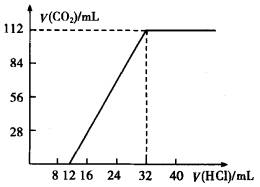
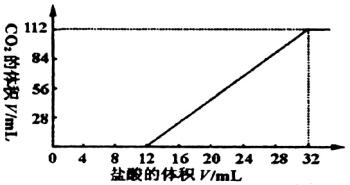
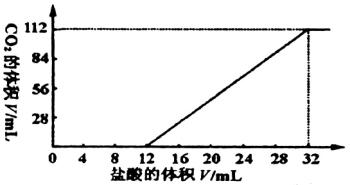
���м����������̼���κͼ�������(Mg��Ca�ȶ��۽���)��һ�ֲ�����̼������ɵĻ���ȡ7.560 g�û���������������ȫ��Ӧ���ų�CO2���Ϊ1.344 L(��״��)����ȡ��������ԭ������ˮ���裬���˳���������1.420 g��ȡ���˺���Һ��1/10����������л����μ�Ũ��Ϊ0.2500 mol/L�����ᣬ��ͬʱ��¼�ų���CO2�����(��״��)�����������������õ���ͼ��ʾ�����ߡ�ͨ�����㣬ȷ�������ּ����̼���εĻ�ѧʽ��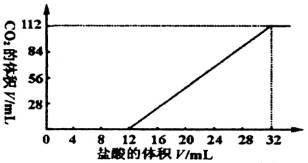
������
| (1)��ͼ�����������̼�����У�
n(CO n(HCO ���˳���1.420 g������(��������������)�ɼ�������ּ����̼���ε�����Ϊ�� 7.56��1.42=6.14(g)�� (2)������������̼�����м����Ԫ�ص����ԭ������Ϊx��y���� (2x+60)��0.03+(y+61)��0.02=6.14�� (2y+60)��0.03+(x+61)��0.02=6.14�� ���������ã�2x+y=156��x+3y=156�� ��Ȼ��x=y����֮��x=y=39�������ԭ�������Ǽ�Ԫ�ص����ݣ������������������(Li��Na��Rb��Cs��Fr)�� (3)�������ּ������̼���Σ�һ��ΪK2CO3(0.03 mol)��һ��ΪKHCO3(0.02 mol)��
|
��ʾ��
| 7.560 g��������������ᷴӦ��ų�1.344 L CO2����֪�ܵĻ������̼���ε����ʵ���Ϊ��n=1.344/22.4=0.06(mol)��
��ͼ����֪����ʼ������ʱ��δ�ų�CO2�����ӵ�12 mL�������ݳ�CO2���ɼ�����12 mL����֮ǰ��ӦΪ��H++CO ����ɼ�12 mL��32 mL(��20
mL,)�������CO2�ų�����ӦΪ��HCO �ݴˣ���ǰ12 mL����������������̼���ε����ʵ���������
|