题目内容
一定量液态化合物XY2,在一定量的O2中恰好完全燃烧,其反应的化学方程式为:XY2(l)+3O2(g)====XO2(g)+2YO2(g);冷却后在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。(1)反应前O2的体积是____________ mL。
(2)化合物XY2的摩尔质量是____________。
(3)若XY2分子中,X、Y两元素的质量之比为3∶16,则X、Y两元素分别为____________和____________(写出元素符号)
(1)672 (2)76 g·mol-1 (3)C S
解析:(1)由题示方程式知,反应前后气体体积不变,因XY2为液态,故反应前O2的体积为672 mL。![]()
(2)因XY2与O2恰好完全反应,故XY2的物质的量为0.01 mol。反应后气体总质量为m=ρV=2.56 g·L-1×672×10-3L=1.72 g。
根据质量守恒定律得,m(XY2)=1.72 g-m(O2)=1.72 g-0.03 mol×32 g·mol-1=0.76 g。所以![]()
(3)由题意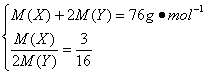
解得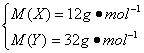
即X为C,Y为S。

练习册系列答案
相关题目