题目内容
【题目】在不同温度下,水溶液中c(H+)与c(OH﹣)关系如图所示.下列说法不正确的是( ) 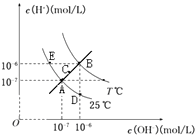
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量NH4Cl的方法
C.E点对应的水溶液中,可能有NH ![]() 、Ba2+、Cl﹣、I﹣大量同时存在
、Ba2+、Cl﹣、I﹣大量同时存在
D.若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性
【答案】B
【解析】解:A.由图象可知,A、E、D都为25℃时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则B>A=D=E,由C点c(OH﹣)×c(H+)可知,C点的Kw大于A点小于B,所以图中五点Kw间的关系为:B>C>A=D=E,故A正确;B.由于A点和C点c(OH﹣)=c(H+),溶液显示中性,而加入氯化铵后溶液显示酸性,所以通过加入氯化铵溶液,无法实现从A点到C点,故B错误;
C.E点c(OH﹣)<c(H+),溶液呈酸性,酸性条件下,NH4+、Ba2+、Cl﹣、I﹣没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故C正确;
D.B点时,Kw=1×10﹣12 , pH=2的硫酸中c(H+)=0.01mol/L,与pH=10的KOH溶液中c(OH﹣)=0.01mol/L,等体积混合后,溶液显中性,故D正确;
故选B.

 名校课堂系列答案
名校课堂系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃