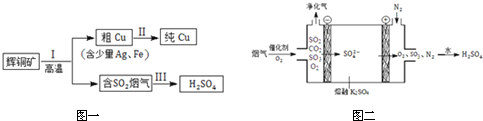
题目内容
9.以下各种模型图都由C、H、O、N中的一种或多种元素构成.下列说法正确的是( )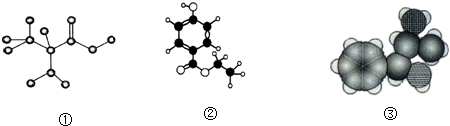
| A. | 图①是球棍模型,其化学式为:C3H7O2N,是一种蛋白质 | |
| B. | 图②是比例模型,其化学式为:C9H13NO,该物质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| C. | 图③是球棍模型,其化学式为:C9H10O3,1 mol该物质能消耗3mol氢氧化钠 | |
| D. | 图③是比例模型,其化学式为:C9H13ON,能够发生消去反应 |
分析 A.图①是球棍模型,表示CH3CH(NH2)COOH;
B.图②是球棍模型,OHC6H4COOCH2CH3;
C.图③是比例模型,表示C6H5CHOHCH(NH2)CH3;
D.图③是比例模型,表示C6H5CHOHCH(NH2)CH3,与-OH相连的C的邻位C上含H.
解答 解:A.图①是球棍模型,表示CH3CH(NH2)COOH,其分子式为C3H7O2N,是一种氨基酸,故A错误;
B.图②是球棍模型,OHC6H4COOCH2CH3,分子式为C9H10O3,能在酸或碱条件下水解,故B错误;
C.图③是比例模型,表示C6H5CHOHCH(NH2)CH3,不与氢氧化钠反应,故C错误;
D.图③是比例模型,表示C6H5CHOHCH(NH2)CH3,分子式为C9H13ON,与-OH相连的C的邻位C上含H,则一定条件下能发生消去反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质及结构模型,能利用模型判断有机物是解答本题的前提,注意把握有机物的官能团与性质的关系来解答,熟悉酯、羧酸、醇的性质是解答的关键,题目难度中等.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
12.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 C>D>B>A | B. | 原子序数 a>b>d>c | ||
| C. | 离子半径 A>B>D>C | D. | 元素失电子能力 A>B>D>C |
20.下列关于两种有机化合物A和B的说法中错误的是( )
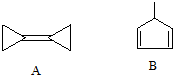

| A. | A的化学式为C6H8 | B. | A的二氯取代产物有4种 | ||
| C. | A与B与溴水反应产物都只有一种 | D. | A分子所有碳原子均在同一平面上 |
17.下列各组离子能大量共存的是( )?
| A. | K+、NH4+、SO42-、NO3- | B. | OH-、K+、NH4+、Cl- | ||
| C. | Fe3+、Cl-、Na+、OH- | D. | Fe2+、H+、SO32-、NO3- |
4.下列装置所示的实验能达到实验目的是( )
| A. |  分离碘酒中 的碘和酒精 | B. | 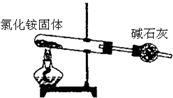 实验室制取氨气 | ||
| C. | 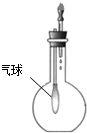 验证NH3的 溶解性 | D. | 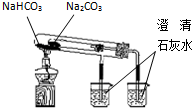 比较Na2CO3、NaHCO3的热稳定性 |
14.对于以下反应:A(s)+3B(g)?2C(g)+D(g),在一定温度和容积固定的容器中,下列判断正确的是( )
| A. | 若反应是放热反应,升高温度,正反应速率增大 | |
| B. | 往容器中通入稀有气体He,由于压强增大,所以反应速率增大 | |
| C. | 往容器中加入少量A,反应速率增大 | |
| D. | 当容器内的压强不再变化,可以判断反应已经达到平衡 |
1.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂志中不含Fe、S元素.且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸钠主要材料,某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量
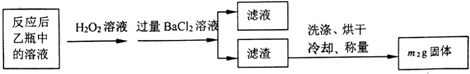
(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量
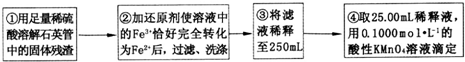
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.500mol/L.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体.

【实验一】测定硫元素的含量

(1)甲装置的作用是除去空气中的二氧化碳,使装置乙中的溶液只吸收黄铁矿煅烧产生的二氧化硫;鼓入空气的作用是提供反应物氧气,排除装置中生成的二氧化硫,使二氧化硫完全被乙吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O (用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大 (填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)④中测定时,标准KMnO4溶液应装入酸式式滴定管,滴定至终点的实验现象为:最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
(7)某同学一共进行了四次滴定实验,实验结果记录如下:
| 试验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KmnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |