题目内容
用氯化钠固体配制1.00mol/L的NaCl溶液95mL,回答下列问题
⑴所需仪器为:托盘天平、量筒、烧杯胶头滴管,若要完成实验,还需要两种玻璃仪器为 、 。
⑵该实验的实验步骤为:
①计算,②称量 gNaCl, ③溶解,④移液,⑤洗涤,⑥定容,⑦ 摇匀。
⑶试分析下列操作,对所配溶液的浓度有何影响。(用偏低、偏高、无影响填空)。
①用天平称量氯化钠后,发现砝码底部有锈斑。所配溶液的浓度 ;
②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容。所配溶液的浓度 ;
③容量瓶不干燥,含有少量蒸馏水。所配溶液的浓度 ;
④若定容时仰视刻度线。所配溶液的浓度 ;
⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度。则所配溶液的浓度 。
⑴100 mL容量瓶 玻璃棒 ⑵5.9 ⑶①偏高 偏高 无影响 偏低 偏低
解析试题分析:(1)由于实验室没有95ml容量瓶,所以要用氯化钠固体配制1.00mol/L的NaCl溶液95mL,则需要100ml容量瓶,另外还缺少溶解和转移时的玻璃棒。
(2)需要氯化钠的质量=0.1L×1.00mol/L×58.5g/mol=5.85g≈5.9g。
(3)根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。①用天平称量氯化钠后,发现砝码底部有锈斑,这说明砝码质量偏大,因此氯化钠的质量偏大,则所配溶液的浓度偏高;②为加速固体溶解,微热烧杯溶液并不断搅拌。在未降至20℃时,就将溶液转移至容量瓶定容,则冷却后容量瓶中溶液的体积偏少,因此所配溶液的浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对所配溶液的浓度不影响;④若定容时仰视刻度线,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低;⑤定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度,则容量瓶中溶液的体积偏大,因此所配溶液的浓度偏低。
考点:考查移动物质的量浓度配制以及误差分析

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案资料:(1)草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色;(2)KMnO4在酸性条件的还原产物为Mn2+。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成。这说明草酸亚铁晶体具有 (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为 ______mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;假设二: ;假设三:
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求具体的操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, | |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为: 。
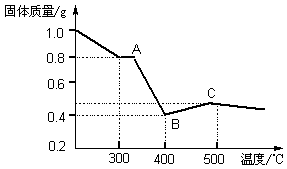
根据图象,如有1.0 g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4 g。某同学由此得出结论:假设一不成立。你是否同意该同学的结论 (填“同意”或“不同意”),并简述理由 。
下列物质中,属于混合物的是
| A.碳酸钠 | B.液态氨 | C.铝热剂 | D.氢氧化钠 |
胶体分散系与其它分散系的本质差别是
| A.是否有丁达尔现象 | B.分散质粒子是否带电 |
| C.是否稳定 | D.分散质直径大小 |
下列说法正确的是
| A.所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B.汽油、柴油和植物油都是碳氢化合物 |
| C.只由一种元素组成的物质,一定是纯净物 |
| D.化学反应的实质就是旧化学键的断裂、新化学键形成过程 |