题目内容
下列说法不正确的是
| A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl |
| C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小 |
| D.常温下,pH=1的稀硫酸与醋酸溶液中,c(SO42-)与c(CH3COO-)之比为2∶1 |
CD
试题分析:A、NaHCO3和Na2CO3混合溶液中存在Na+、H+、OH-、HCO3-、CO32-5种离子,根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),正确;B、常温下,浓度均为0.1 mol·L-1下列各溶液中氢氧化钠是强碱,pH最大;氯化铵溶液呈酸性,pH最小。CO32-的水解程度大于HCO3-的水解程度,所以Na2CO3溶液的碱性强于NaHCO3溶液的碱性,pH前者大,正确;C、向冰醋酸中逐滴加水,电离平衡正向移动,所以醋酸的电离程度增大;开始冰醋酸中的氢离子浓度为0,随着水的滴入,氢离子浓度逐渐增大,pH减小,继续滴水,尽管醋酸电离程度增大,但水体积的改变量大于氢离子物质的量的改变量,最终氢离子浓度降低,pH增大,所以pH是先减小后增大,错误;D、pH相等的硫酸和醋酸溶液的氢离子浓度相等,都是0.1mol/L,而c(SO42-)=0.05mol/L,c(CH3COO-)=0.1mol/L,所以c(SO42-)与c(CH3COO-)之比为1:2,错误,答案选CD。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
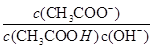 不变
不变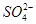 、
、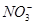
 、
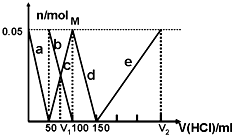
、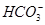 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是