题目内容
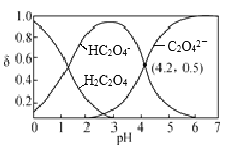
【题目】H2C2O4水溶液中部分微粒的分布分数δ与pH关系如图所示,下列说法正确的是

A.向H2C2O4溶液中滴加NaOH溶液至pH=2.5:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B.由图可知:H2C2O4的Ka2=10-4.2
C.向H2C2O4溶液中滴加NaOH溶液至pH=7,则溶液中:2c(C2O42-)>c(Na+)
D.将0.01 mol·L-1的H2C2O4溶液与0.02 mol·L-1 NaOH溶液等体积混合后的溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
【答案】BD
【解析】
H2C2O4水溶液中加入NaOH,H2C2O4与碱中和,转化为HC2O4-,则c(H2C2O4)减小,c(HC2O4-)增大,随着NaOH加入,H2C2O4全部转化为HC2O4-,再继续加入NaOH,HC2O4-与碱反应转化为C2O42-,则c(HC2O4-)减小,c(C2O42-)增大,则图中各曲线代表的微粒分别为:
 以此分析解答。
以此分析解答。
A.根据图像所示,pH=2.5时,c(HC2O4-)远大于c(C2O42-)和c(H2C2O4),则不可能得到c(H2C2O4)+c(C2O42-)>c(HC2O4-),故A错误;
B. 由图可知:pH=4.2时,c(C2O42-)=c(HC2O4-),H2C2O4的Ka2=![]() =10-4.2,故B正确;
=10-4.2,故B正确;
C. 溶液中存在电荷守恒:c(H+)+ c(Na+)= 2c(C2O42-)+c(HC2O4-)+ c(OH-),向H2C2O4溶液中滴加NaOH溶液至pH=7,c(H+)=c(OH-),则溶液中:c(Na+)= 2c(C2O42-)+c(HC2O4-),则c(Na+)>2c(C2O42-),故C错误;
D. 将0.01 mol·L-1的H2C2O4溶液与0.02 mol·L-1 NaOH溶液等体积混合后的溶液中恰好完全反应,形成溶质为Na2C2O4的溶液,该溶液中质子守恒式为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故D正确;
答案选BD。

【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
① 称量1.000 g样品溶于水,配成250 mL溶液;
② 准确量取25.00 mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用0.1000 mol/L 的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)用_______滴定管(填“酸式”或“碱式”)盛装0.1000 mol/L的盐酸标准液。
(2)判断滴定终点到达时的现象_________。
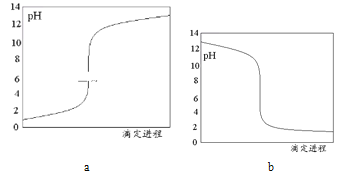
(3)该滴定过程的滴定曲线是下列的______(选填“a”、“b”)。
(4)若出现下列情况,测定结果偏高的是__________。
a 滴定前用蒸馏水冲洗锥形瓶
b 在振荡锥形瓶时不慎将瓶内溶液溅出
c 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
(5)通过计算可知该烧碱样品的纯度为______________。
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大





