题目内容
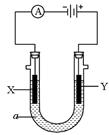
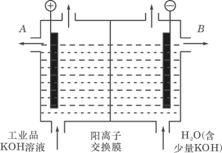
(1)离子交换膜法电解饱和食盐水制碱技术已经广泛应用于工业化生产,电解槽中涂有镍涂层的碳钢网和金属钛网(惰性电极)作两极。其中涂有镍涂层的碳钢网作___________极,其电极反应方程式为______________________________________________。由于饱和食盐水中含有泥沙、Ca2+、Mg2+、Fe3+、①过滤 ②NaOH ③BaCl2 ④盐酸 ⑤Na2CO3
当电解
(2)摩托罗拉公司研发了一种由甲醇(CH3OH)和氧气以及强碱作电解质溶液的新型手机电池。若放电过程中,甲醇完全氧化产生的CO2被碱充分吸收生成![]() 。则该电池反应的总离子方程式为________________________________________;甲醇在_____________极发生_____________反应。
。则该电池反应的总离子方程式为________________________________________;甲醇在_____________极发生_____________反应。
(1)阴 2H++2e-====H2↑ ③⑤②①④ 1
(2)2CH3OH+3O2+4OH-====2![]() +6H2O 负 氧化
+6H2O 负 氧化
解析:涂有镍涂层的碳钢网是活性电极,只能作为该电解池的阴极,其电极反应式为2H++2e-====H2↑。粗食盐水中所含四种杂质离子各自除去的方法如下:Ca2+![]()
![]() (余)
(余)![]() CO2↑,Mg2+
CO2↑,Mg2+![]() OH-(余)
OH-(余)![]() H2O,Fe3+
H2O,Fe3+![]() OH-(余)
OH-(余)![]() H2O,
H2O,![]()
![]() Ba2+(余)
Ba2+(余)![]()
![]() (余)
(余)![]() CO2↑,
CO2↑,![]() 的除去方法中已决定了BaCl2、Na2CO3、HCl的加入顺序,Fe3+、Mg2+的除去方法决定了NaOH在HCl前加入,考虑到Ca(OH)2为微溶物,需用Na2CO3除Ca2+后再加NaOH,则NaOH应在Na2CO3之后加入。综合以上分析,可得合理的操作顺序为③⑤②①④。关系式NaOH—e-,转移1 mol e-时理论上有1 mol NaOH生成。(2)该原电池中自发的氧化还原反应为2CH3OH+3O2====2CO2+4H2O,CO2进一步被强碱(设为NaOH)溶液吸收,CO2+2NaOH====Na2CO3+H2O,消去CO2得总方程式为2CH3OH+3O2+4NaOH====2Na2CO3+6H2O,改写为离子方程式为2CH3OH+3O2+4OH-==== 2
的除去方法中已决定了BaCl2、Na2CO3、HCl的加入顺序,Fe3+、Mg2+的除去方法决定了NaOH在HCl前加入,考虑到Ca(OH)2为微溶物,需用Na2CO3除Ca2+后再加NaOH,则NaOH应在Na2CO3之后加入。综合以上分析,可得合理的操作顺序为③⑤②①④。关系式NaOH—e-,转移1 mol e-时理论上有1 mol NaOH生成。(2)该原电池中自发的氧化还原反应为2CH3OH+3O2====2CO2+4H2O,CO2进一步被强碱(设为NaOH)溶液吸收,CO2+2NaOH====Na2CO3+H2O,消去CO2得总方程式为2CH3OH+3O2+4NaOH====2Na2CO3+6H2O,改写为离子方程式为2CH3OH+3O2+4OH-==== 2![]() +6H2O。甲醇是原电池反应中的还原剂,其在负极上发生氧化反应。
+6H2O。甲醇是原电池反应中的还原剂,其在负极上发生氧化反应。

 应用题作业本系列答案
应用题作业本系列答案