题目内容
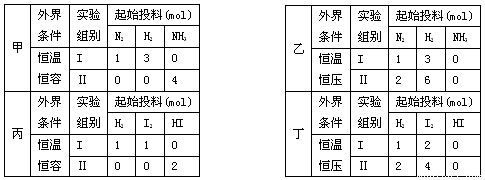
现有甲、乙两个实验,进行反应N2(g)+3H2(g)?2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)?2HI(g)△H=-akJ?mol-1,实验条件和起始投料如下表所示,以下结论正确的是( )
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
分析:A、恒温恒容下,平衡Ⅱ中按化学计量数转化到左边可得2molN2、6molH2,等效为在平衡Ⅰ基础上压强增大一倍,平衡时氮气转化率增大,平衡时平衡Ⅱ中氨气的物质的量大于平衡Ⅰ中氨气的2倍,用转化率表示出平衡时氨气的物质的量,利用平衡时平衡Ⅱ中氨气的物质的量大于平衡Ⅰ中氨气的2倍,进行判断;
B、乙组中,恒温恒压,平衡Ⅱ与平衡Ⅰ中n(N2):n(H2)=1:3,为等效平衡,平衡时对应各组分的浓度相同;
C、丙组中,恒温恒容下,平衡Ⅱ按化学计量数转化到左边可得1molH2、1molI2,对应各组分的物质的量相同,二者为等效平衡,平衡时对应各组分的物质的量相等,令平衡时H2的物质的量为xmol,则平衡I中参加反应的氢气为(1-x)mol,平衡Ⅱ中参加反应的碘为2xmol,根据热化学方程式计算反应热,再进行计算判断;
D、丁组中,恒温恒压,平衡Ⅱ中物质的量变为平衡I的2倍,平衡Ⅱ的体积变为2倍,各物质的量浓度相同,反应速率相同.
B、乙组中,恒温恒压,平衡Ⅱ与平衡Ⅰ中n(N2):n(H2)=1:3,为等效平衡,平衡时对应各组分的浓度相同;
C、丙组中,恒温恒容下,平衡Ⅱ按化学计量数转化到左边可得1molH2、1molI2,对应各组分的物质的量相同,二者为等效平衡,平衡时对应各组分的物质的量相等,令平衡时H2的物质的量为xmol,则平衡I中参加反应的氢气为(1-x)mol,平衡Ⅱ中参加反应的碘为2xmol,根据热化学方程式计算反应热,再进行计算判断;
D、丁组中,恒温恒压,平衡Ⅱ中物质的量变为平衡I的2倍,平衡Ⅱ的体积变为2倍,各物质的量浓度相同,反应速率相同.
解答:解:A、恒温恒容下,平衡Ⅱ中按化学计量数转化到左边可得2molN2、6molH2,等效为在平衡Ⅰ基础上压强增大一倍,平衡时氮气转化率增大,平衡时平衡Ⅱ中氨气的物质的量大于平衡Ⅰ中氨气的2倍.平衡Ⅰ中平衡时n(NH3)=2α1mol,平衡Ⅱ中平衡时n′(NH3)=4(1-α2)mol,所以2×2α1mol<4(1-α2)mol,整理得α1+α2<1,故A错误;
B、乙组中,恒温恒压,平衡Ⅱ与平衡Ⅰ中n(N2):n(H2)=1:3,为等效平衡,平衡时对应各组分的浓度相同,平衡Ⅱ中NH3的浓度与平衡Ⅰ中NH3的浓度相等,故B错误;
C、丙组中,恒温恒容下,平衡Ⅱ按化学计量数转化到左边可得1molH2、1molI2,对应各组分的物质的量相同,二者为等效平衡,平衡时对应各组分的物质的量相等,令平衡时H2的物质的量为xmol,则平衡I中参加反应的氢气为(1-x)mol,平衡Ⅱ中参加反应的碘为2xmol,所以平衡I中放出的热量为Q1=(1-x)mol×akJ?mol-1=(1-x)akJ,平衡Ⅱ吸收的热量为Q2=
×akJ?mol-1=xakJ,所以Q1+Q2=(1-x)akJ+xakJ=akJ,故C正确;
D、丁组中,恒温恒压,平衡Ⅱ中物质的量变为平衡I的2倍,平衡Ⅱ的体积变为2倍,各物质的量浓度相同,反应速率相同,到达平衡的时间相等,故D错误.
故选:C.
B、乙组中,恒温恒压,平衡Ⅱ与平衡Ⅰ中n(N2):n(H2)=1:3,为等效平衡,平衡时对应各组分的浓度相同,平衡Ⅱ中NH3的浓度与平衡Ⅰ中NH3的浓度相等,故B错误;
C、丙组中,恒温恒容下,平衡Ⅱ按化学计量数转化到左边可得1molH2、1molI2,对应各组分的物质的量相同,二者为等效平衡,平衡时对应各组分的物质的量相等,令平衡时H2的物质的量为xmol,则平衡I中参加反应的氢气为(1-x)mol,平衡Ⅱ中参加反应的碘为2xmol,所以平衡I中放出的热量为Q1=(1-x)mol×akJ?mol-1=(1-x)akJ,平衡Ⅱ吸收的热量为Q2=
| 2xmol |
| 2 |
D、丁组中,恒温恒压,平衡Ⅱ中物质的量变为平衡I的2倍,平衡Ⅱ的体积变为2倍,各物质的量浓度相同,反应速率相同,到达平衡的时间相等,故D错误.
故选:C.
点评:本题考查等效平衡、平衡移动、反应热的计算、化学平衡计算等,难度较大,注意对等效平衡的理解与运用.

练习册系列答案
相关题目
现有甲、乙两个实验,进行反应N2(g)+3H2(g) 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)  2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是
2HI(g) ?H=-akJ?mol—1,实验条件和起始投料如下表所示,以下结论正确的是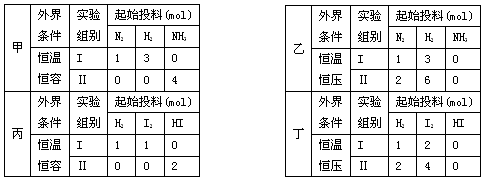
| A.甲组中,若平衡时N2和NN3的转化率分别为α1 和α2,则α1 +α2=1 |
| B.乙组中,平衡Ⅱ中NH3的浓度是平衡Ⅰ的二倍 |
| C.丙组中,若达平衡时Ⅰ中放热Q1kJ, Ⅱ中吸热Q2kJ,则Q1+Q2=a |
| D.丁组中,达平衡所需时间:Ⅰ小于Ⅱ |
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量. 2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)
2NH3(g);丙、丁两个实验,进行反应H2(g)+I2(g)