题目内容
【题目】(加试题)水是“生命之基质”,是“永远值得探究的物质”。
(1) 关于反应H2(g)+1/2O2(g)H2O(l),下列说法不正确的是________。
A.焓变ΔH<0,熵变ΔS<0
B.可以把反应设计成原电池,实现能量的转化
C.一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行
D.选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)________。
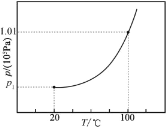
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)________。


(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因________。
②如果水的离子积Kw从1.0×1014增大到1.0×1010,则相应的电离度是原来的________倍。
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。


下列说法合理的是________。
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是________。
②制备H2O2的总反应方程式是________。
【答案】C 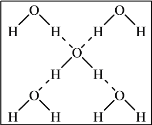
 水的电离为吸热过裎,升高温度有利于电离(压强对电离平衡影响不大) 100 ABD 2HSO4--2eS2O82-+2H+或2SO42--2eS2O82- 2H2O
水的电离为吸热过裎,升高温度有利于电离(压强对电离平衡影响不大) 100 ABD 2HSO4--2eS2O82-+2H+或2SO42--2eS2O82- 2H2O![]() H2O2+H2↑
H2O2+H2↑
【解析】
本题以水为载体考查了化学反应原理的相关知识,如电化学,化学平衡等。
(1)A.氢气燃烧是放热反应,ΔH<0,该反应中气体变为液体,为熵减过程,故ΔS<0,A项正确;
B.该反应可设计为氢氧燃料电池,其化学能转为电能,B项正确;
C.某条件下自发反应是一种倾向,不代表真实发生,自发反应往往也需要一定的反应条件才能发生,如点燃氢气,C项错误;
D.催化剂降低活化能,加快反应速率,D项正确。
故答案选C。
(2)①H2O电子式为![]() ,存在两对孤电子对,因而O原子可形成两组氢键,每个H原子形成一个氢键,图为:
,存在两对孤电子对,因而O原子可形成两组氢键,每个H原子形成一个氢键,图为:

②100℃,101kPa为水的气液分界点,20℃和p1为另一个气液分界点,同时升高温度和增加压强利于水从液体变为气体,因而曲线为增曲线,可做图为:

(3)①水的电离为吸热过裎,升高温度有利于电离,压强对固液体影响不大,可忽略。
②c(H+)=![]() ,当Kw=1.0×10-14,c1(H+)=10-7mol/L,当Kw=1.0×10-10,c2(H+)=10-5mol/L,易知后者是前者的100倍,所以相应的电离度是原来的100倍。
,当Kw=1.0×10-14,c1(H+)=10-7mol/L,当Kw=1.0×10-10,c2(H+)=10-5mol/L,易知后者是前者的100倍,所以相应的电离度是原来的100倍。
③A.观察左侧x-t图像可知,CO先增加后减少,CO2一直在增加,所以CO为中间产物,CO2为最终产物,A项正确;
B.观察左侧x-t图像,乙醇减少为0和CO最终减少为0的时间一致,而右图xCO-t图像中550℃,CO在15s减为0,说明乙醇氧化为CO2趋于完全,B项正确;
C.乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,但两者数值不相等,比值为化学计量数之比,等于1:2,C项错误;
D.随着温度的升高,乙醇的氧化速率和一氧化碳氧化速率均增大,但CO是中间产物,为乙醇不完全氧化的结果,CO峰值出现的时间提前,且峰值更高,说明乙醇氧化为CO和CO2速率必须加快,且大于CO的氧化速率,D项正确。
故答案选ABD。
(4)①电解池使用惰性电极,阳极本身不参与反应,阳极吸引HSO4-(或SO42-)离子,并放电生成S2O82-,因而电极反应式为2HSO4--2e=S2O82-+2H+或2SO42--2e=S2O82- 。
②通过电解NH4HSO4溶液产生(NH4)2S2O8和H2。由题中信息可知,生成的NH4HSO4可以循环使用,说明(NH4)2S2O8与水反应除了生成H2O2,还有NH4HSO4生成,因而总反应中只有水作反应物,产物为H2O2和H2,故总反应方程式为2H2O![]() H2O2+H2↑。
H2O2+H2↑。

 小题狂做系列答案
小题狂做系列答案【题目】某小组研究FeCl3与Na2S的反应,设计了如下实验:
| 实验a | 实验b | 实验c | |
FeCl3 体积 | 5 mL | 10 mL | 30 mL | |
实验 现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液pH=3.7 |
I. 探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。
b、c中黑色沉淀部分变为红褐色。
(1)① 同学甲认为实验a中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是________。
② 同学乙认为实验b的黑色沉淀物中有FeS则一定混有S,理由是_________。
③ 设计实验检验b的黑色沉淀物中混有硫。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。
实验证明了b中黑色沉淀混有S,试剂a是_____,观察到的现象为_____。
II. 探究实验a中Fe3+与S2-没有发生氧化还原反应的原因
经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨

(2)①试剂X和Y分别是__________
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_______。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_______。
④由此得出的实验结论是__________。
III. 探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
实验1 | 实验2 |
|
|
(3)①用离子方程式解释实验1中的现象_________、_________(写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因______。
【题目】某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是________。
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→________。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象________。
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是________。
②从操作上分析引入杂质的原因是________。
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Al3+ | 3.0 | 4.7 |
Fe3+ | 1.1 | 2.8 |
Ca2+ | 11.3 | - |
Mg2+ | 8.4 | 10.9 |
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→(___)→(___)→(___)→(___)→(___)→(___)→MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤






