题目内容
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是
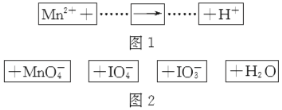
A.IO4-作氧化剂
B.若有1 mol Mn2+参加反应转移5 mol电子
C.氧化剂与还原剂的物质的量之比为5∶2
D.配平后Mn2+、H+的化学计量数分别为2、3
【答案】D
【解析】
试题分析:Mn2+作反应物,则MnO4-作生成物,化合价升高,因此IO4-作反应物,IO3-作生成物,H+作生成物,则H2O作反应物,因此反应方程式为:Mn2++IO4-+H2O→H++MnO4-+IO3-,根据化合价的升降法配平,2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,A、根据上述分析IO4-化合价降低,作氧化剂,故说法正确;B、根据离子反应方程式,消耗2molMn2+转移电子10mole-,则消耗1molMn2+转移电子5mole-,故说法正确;C、根据反应方程式,氧化剂和还原剂的物质的量比值为5:2,故说法正确;D、根据反应方程式,H+的系数为6,故说法错误。

练习册系列答案
相关题目



