题目内容
【题目】某同学想利用原电池反应检测Zn和Cu的金属活动性顺序.请你帮他选择适宜的材料和试剂设计一个原电池,并完成下列实验报告:
实验目的:探究Zn和Cu的金属活动性顺序
(1)电极材料:正极:;负极:;电解质溶液: .
(2)写出电极反应式:正极:;负极: .
(3)画出装置图:
(4)实验现象: .
(5)实验结论: .
【答案】
(1)铜片;锌片;CuSO4溶液
(2)Cu2++2e﹣=Cu;Zn﹣2e﹣=Zn2+
(3)由(1)可知原电池的装置图为 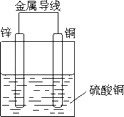
(4)负极不断溶解,正极上有红色固体析出,溶液蓝色变浅
(5)金属活动性Zn>Cu
【解析】解:(1)利用反应Zn+CuSO4=ZnSO4+Cu设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液应为CuSO4 , 所以答案是:铜片;锌片; CuSO4溶液;(2)原电池工作时,正极反应式为Cu2++2e﹣=Cu,负极反应式为Zn﹣2e﹣=Zn2+ , 所以答案是:Cu2++2e﹣=Cu;Zn﹣2e﹣=Zn2+;(3)由(1)可知原电池的装置图为 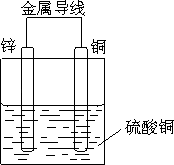 ,所以答案是:
,所以答案是:  ;(4)正极发生还原反应,生成红色金属铜,溶液蓝色变浅.负极发生氧化反应,锌逐渐溶解,所以答案是:负极不断溶解,正极上有红色固体析出,溶液蓝色变浅;(5)锌逐渐溶解,正极析出红色金属铜,说明金属活动性Zn>Cu,所以答案是:金属活动性Zn>Cu.
;(4)正极发生还原反应,生成红色金属铜,溶液蓝色变浅.负极发生氧化反应,锌逐渐溶解,所以答案是:负极不断溶解,正极上有红色固体析出,溶液蓝色变浅;(5)锌逐渐溶解,正极析出红色金属铜,说明金属活动性Zn>Cu,所以答案是:金属活动性Zn>Cu.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
