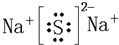题目内容
短周期元素的离子aA3+、bB+、cC2-、dD-具有相同的电子层结构,下列判断正确的是( )
分析:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,故C为O元素,D为F元素,A、B为金属应处于第三周期,A为Al元素,B为Na元素,结合元素周期律解答.
解答:解:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,故C为O元素,D为F元素,A、B为金属应处于第三周期,A为Al元素,B为Na元素,
A.C为O元素,D为F元素,故c=8、d=9,则质子数:c<d,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则稳定性H2O<HF,故B错误;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故C正确;
D.同周期随原子序数增大原子半径减小,故原子半径Na>Al,故D错误,
故选C.
A.C为O元素,D为F元素,故c=8、d=9,则质子数:c<d,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则稳定性H2O<HF,故B错误;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故C正确;
D.同周期随原子序数增大原子半径减小,故原子半径Na>Al,故D错误,
故选C.
点评:本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.

练习册系列答案
相关题目
已知短周期元素的离子aA+、cC2-、bB3+、dD-具有相同的电子层结构,则下列叙述正确的是( )
A、25℃时,bB3+、dD-在
| ||||
| B、在AD溶液中存在:D-+H2O?HD+OH-,故其溶液呈碱性 | ||||
| C、离子半径:cC2->dD->bB3+>aA+ | ||||
D、电解AD水溶液的化学方程式为:2AD+2H2O
|