��Ŀ����
��ҵ���������β���к��е�������NOx��NO��NO2�Ļ������費��N2O4��������̬���������ཡ�������ϴ����в��
��1����ҵ�Ͽ��ð������շ�����NOx ����Ӧԭ�����£�
4xNH3 +6 NOx ![]() ��2x + 3��N2 + 6xH2O
��2x + 3��N2 + 6xH2O
ij��ѧ��ȤС��ģ��ô������̵�ʵ��װ�����£�

��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ �� ��
��װ��D�м�ʯ�ҵ������� �� ��
��2����ҵ��Ҳ����Na2CO3��Һ���շ�����NOx ��
��֪�� NO������Na2CO3��Һ��Ӧ��
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ��I��
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 ��II��
�ٵ�NOx��Na2CO3��Һ��ȫ����ʱ��x��ֵ�������� �� ������ĸ����
A��1.3 B��1.6 C��1.8
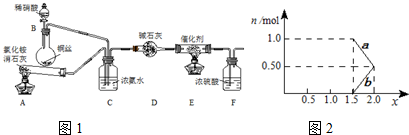
�ڽ�1mol NOx ͨ��Na2CO3��Һ�У�����ȫ����ʱ����Һ�����ɵ�NO3����NO2���������ӵ����ʵ�����x�仯��ϵ��ͼ��ʾ��

ͼ���߶�a��ʾ �� ������xֵ�仯�Ĺ�ϵ������������������Ϊ21.2%�� Na2CO3��Һ���գ�����ҪNa2CO3��Һ���� �� g��
����������Na2CO3��Һ��ȫ����NOx��ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g����NOx�е�xֵΪ �� ��
��3���������շ���Na2CO3��Һ���շ�����NOxβ����ͬ���ŵ��� �� ��
��10�֣�
��1����2NH4Cl +Ca(OH)2 ![]() CaCl2 + 2NH3�� + 2H2O��2�֣�
CaCl2 + 2NH3�� + 2H2O��2�֣�
�ڳ�ȥ�����к��е�ˮ������1�֣�
��2���� A��1�֣�
�� NO2�� ��1�֣� 250 ��2�֣�
��15/8 ����1.875 ����2�֣�
��3�����ж�����ת�����������ʣ���ֹ�ж��������Ⱦ��1�֣�
����:
��2����Ϊ����ȫ���� n(NO2) �� n(NO)
���ü�������x=1.5 ����ӦΪNO��NO2�������ʵ�����Ϊ1�U1����Iʽ��Ӧ��û��NO3������aӦ�ñ�ʾNO2����
���غ㷨����Ӧ���ɵ�NaNO3��NaNO2�е�Ԫ������Ԫ��֮��Ϊ1�U1������1molNOx����ȫ����������̼����0.5mol������Ϊ53g �������̼������Һ������Ϊ250g
��3������NO2�봿�Ӧ������CO2Ϊa mol
��NO��NO2�봿�Ӧ������CO2Ϊb mol
2NO2 + Na2CO3=NaNO2 + NaNO3 + CO2 ��m = 48g
a 48a
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 ��m = 32g
b 32b
![]()
![]() a+b=1 a=0.75mol
a+b=1 a=0.75mol
48a+32b=44 b=0.25mol
n(NO2) = 0.75mol��2+0.25mol=1.75mol
n(NO) = 0.25mol
x==![]()
![]() =1.875
=1.875

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�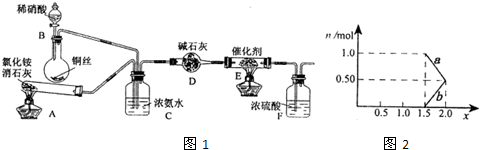

 �£�
�£�
