题目内容
【题目】利用下列反应:![]() 设计一个原电池,请选择适当的材料和试剂。
设计一个原电池,请选择适当的材料和试剂。
I.![]() 请写出你选用的正极材料、负极材料、电解质溶液
请写出你选用的正极材料、负极材料、电解质溶液![]() 写化学式
写化学式![]() :正极为_____________ ,电解质溶液:_____________ ;
:正极为_____________ ,电解质溶液:_____________ ;
![]() 负极反应式: ____________________;
负极反应式: ____________________;
![]() 溶液中
溶液中![]() 向 __________ 极移动。
向 __________ 极移动。
II.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
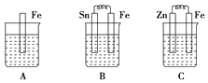
(1)B中Sn极的电极反应式为_________________。
(2)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____________________。
【答案】碳棒 FeCl3 Fe-2e-=Fe2+ 正 2H++2e-=H2↑ B>A>C
【解析】
I.在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电极反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe弱的金属或非金属材料,电解质溶液为含Fe3+离子的溶液,如FeCl3,原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极移动,阴离子向负极移动,以形成闭合回路。
II. ①根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
②铁的化学性质,能与酸反应;电化学腐蚀的速率大于化学腐蚀的速率,金属作原电池正极时得到保护。
I.(1)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电极反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe弱的金属或非金属材料如碳棒,电解质溶液为含Fe3+离子的溶液,如FeCl3;
(2)由(1)解答可知,负极反应为Fe-2e-=Fe2+;
(3)原电池工作时,电子从负极经外电路流向正极,溶液中阳离子向正极C 电极方向移动,阴离子向负极移动,以形成闭合回路;
II.(1)铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大;
(2)金属活动性Zn>Fe>Sn,B构成原电池,Fe为负极,加快了对Fe的腐蚀速率;C构成原电池,Zn为负极,发生氧化反应,Fe为正极,被保护,C中锌与硫酸反应的离子方程式为:Zn+2H+=Zn2++H2↑,A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁作原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率大于有保护措施的腐蚀,所以A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
