题目内容
有CuO和Fe2O3组成的混合物ag,向其中加入2mol/L的硫酸50mL,恰好完全反应。如将2ag该混合物在足量H2中加热,使其充分反应,冷却后剩余固体的质量为:
A.(2a-1.6)g B.2(a-1.6)g c.(a-1.6)g D.3.2g
A.(2a-1.6)g B.2(a-1.6)g c.(a-1.6)g D.3.2g
B
正确答案:B
设:CuO和Fe2O3组成的混合物ag中,CuO xmol,Fe2O3 ymol,则有:80x+160y=a
CuO+H2SO4=CuSO4+H2O
1 1
Xmol xmol
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
1 3
Ymol 3ymol
则有:x+3y=2*0.05
80x+160y=a
解得 x=(3a-16)/80
y=(8-a)/80
混合物ag在足量H2中加热,使其充分反应,冷却后剩余固体为铜和铁
CuO ~ Cu Fe2O3 ~ 2Fe
1 1 1 2
x="(3a-16)/80" mol y="(8-a)/80" mol
冷却后剩余固体质量为:铁的质量和铜的质量
(3a-16)/80mol×64g·mol-1+2(8-a)/80mol×56g·mol-1=(a – 1.6)g
所以:如将2ag该混合物在足量H2中加热,使其充分反应,冷却后剩余固体的质量为:2(a – 1.6)g,B正确。

练习册系列答案
相关题目
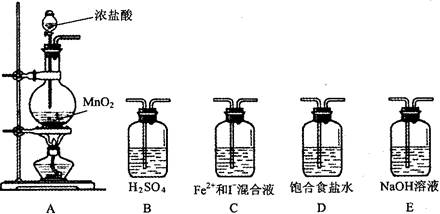

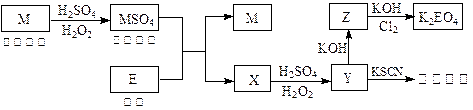
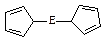 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。