题目内容
在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g)  x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
x Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
【答案】
2M(g) + 3N(g)  x Q(g)
+ 3R(g)
x Q(g)
+ 3R(g)
起始量(mol) 2 3 0 0
转化量(mol) 1.6 2.4 0.8x 2.4
平衡量(mol) 0.4 0.6 0.8x 2.4
所以用气体M来表示该反应的化学反应速率是
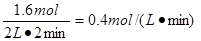
因为平衡时Q的浓度为0.4mol/L
所以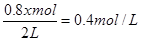 ,解得x=1
,解得x=1
因为压强之比是相应的物质的量之比
所以反应前后的压强比为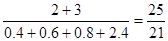
N的转化率是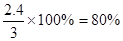
平衡时气体Q所占的体积分数为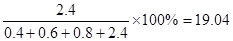
【解析】考查有关化学反应速率的计算。在有关反应速率的计算时一般采用三段式进行计算,即根据反应式分别列出起始量、转化量和平衡量(或某时刻的量),然后在根据已知条件进行列式计算。

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
工业生产苯乙烯是利用乙苯的脱氢反应:
针对上述反应,在其它条件不变时,下列说法正确的是( )

针对上述反应,在其它条件不变时,下列说法正确的是( )
| A、加入适当催化剂,可以提高苯乙烯的产量 | B、在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | C、仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件 | D、加入乙苯至反应达到平衡过程中,混合气体的平均相对分子质量不断增大 |
在一定条件下存在反应:I2(g)+H2(g)?2HI(g),其正反应放热.现有3个相同的2L恒容绝热(与外界没有热量交换)密闭容器甲、乙、丙,在甲中充入1mol I2(g)和1mol H2(g),在乙中充入2mol HI(g),在丙中充入2mol I2(g)和2mol H2(g),在一定温度下下开始反应.达到平衡时,下列说法不正确的是( )
| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
 2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( )
2NH3(g)(放热反应)的下列条件后,有关的叙述中错误的是( ) CO(NH2)2
(l) + H2O (l)。
CO(NH2)2
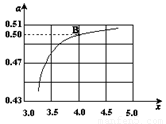
(l) + H2O (l)。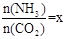 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。