题目内容
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l)。
CO(NH2)2
(l) + H2O (l)。
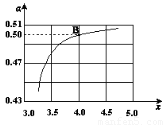
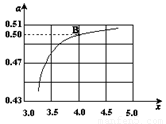
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)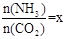 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
(1)< a (共2分,各1分)
(2)c(NH3)增大,平衡正向移动,所以CO2的转化率增大 (1分)
(3)25% (2分) 
(4)12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl
(5)NH3 (1分) NH4Cl 和HCl (各0.5分,共1分)
(6)0.16 (2分)
【解析】
试题分析:(1)由于合成氨的反应是可逆反应,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后不可能有4mol氨气生成,故放出的热量为Q<184.8kJ。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是 a.3v逆(N2)=v正(H2) 相当于同一物质的正逆反应相等,正确;
(2)根据方程式,c(NH3)增大,平衡正向移动,所以CO2的转化率增大。
(3)图中的B点处,x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为50%,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.5mol,依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应的氨气为1mol,NH3的平衡转化率=1/4×100%=25%;故答案为:25%;
(4)运用氧化还原反应原理书写为2Cl2+15NH3= 4 N2+ 7 NH4Cl + 17 HCl ,转移电子数为24e。
(5)反应③中的还原剂是NH3,还原产物是NH4Cl 和HCl。34.生成气体9.408L(标准状况),可求得其中氮气占了4/21,则被氧化的气体的物质的量就为氮气的8倍,即为0.16 mol。
考点:本题考查了化学能与热能关系分析判断,化学平衡状态的判断,氧化还原相关计算。