题目内容
【题目】某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱.实验装置如下,请根据要求回答下列问题: 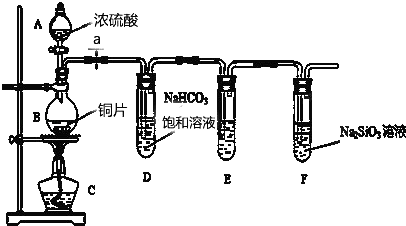
(1)填写所示仪器名称A
(2)实验步骤:连接仪器、、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是 . 装置E中盛足量酸性KMnO4溶液的作用是
②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是 . 请写出F 中发生反应的离子方程式
③依据试管D中的发生的反应,能否证明硫元素的非金属性强于碳元素的非金属性(填“能”或“否”),原因是 .
【答案】
(1)分液漏斗
(2)检验装置气密性
(3)Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;除去二氧化硫气体;强酸制取弱酸;CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣;否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物)
CuSO4+SO2↑+2H2O;除去二氧化硫气体;强酸制取弱酸;CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣;否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物)
【解析】解:(1)A名称是分液漏斗,所以答案是:分液漏斗;(2)连接好仪器后,要检验装置气密性,然后装药品,否则易导致实验失败,所以答案是:检验装置气密性;(3)①铜和浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液除去二氧化硫气体,所以答案是:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液除去二氧化硫气体,所以答案是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;除去二氧化硫气体;②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,所以可以根据强酸制取弱酸判断非金属性强弱,其离子方程式为CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣ , 所以答案是:强酸制取弱酸;CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣;③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱,亚硫酸不是S元素的最高价氧化物的水化物,所以不能据此判断非金属性强弱,所以答案是:否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物).
CuSO4+SO2↑+2H2O;除去二氧化硫气体;②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,所以可以根据强酸制取弱酸判断非金属性强弱,其离子方程式为CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣ , 所以答案是:强酸制取弱酸;CO2+SiO32﹣+H2O=H2SiO3↓+CO32﹣;③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱,亚硫酸不是S元素的最高价氧化物的水化物,所以不能据此判断非金属性强弱,所以答案是:否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物).
【考点精析】根据题目的已知条件,利用非金属在元素周期表中的位置及其性质递变的规律的相关知识可以得到问题的答案,需要掌握在目前已知的112种元素中,非金属元素有22种,除H外非金属元素都位于周期表的右上方(H在左上方).F是非金属性最强的元素.

 ABC考王全优卷系列答案
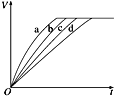
ABC考王全优卷系列答案【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A. 反应达平衡时,X的转化率为50%
B. 反应可表示为:X+3Y![]() 2Z,其平衡常数为1 600
2Z,其平衡常数为1 600
C. 改变压强可以改变此反应的平衡常数
D. 改变温度可以改变此反应的平衡常数
【题目】仔细分析下列表格中烃的排列规律,判断排列在第16位的烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | … |
A.C6H12B.C6H14C.C7H12D.C7H14