题目内容
下列相关离子方程式的书写正确的是
A.铁溶于适量硝酸中: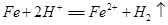 |
B.向水中通入少量氯气: |
C.碳酸氢钠溶液中加入过量 |
D.硫酸溶液中加入过量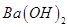 溶液: 溶液: |
C
解析试题分析:A、铁与硝酸反应不生成H2,错误;B、HClO为弱酸,不能拆为H+和ClO?,错误;C、NaHCO3与过量的Ba(OH)2反应生成BaCO3沉淀、H2O和NaOH,正确;D、硫酸溶液与过量氢氧化钡反应,离子方程式为:Ba2+ + 2OH? +2H+ + SO42? =BaSO4↓+ 2H2O ,错误。
考点:本题考查离子方程式的书写。

练习册系列答案
相关题目
在无色透明的溶液中可以大量共存的离子组是
| A.H+、K+、Fe2+、NO3- | B.OH-、Cl-、Na+、NH4+ |
| C.Mg2+、K+、Cl-、NO3- | D.Cu2+、NO3-、OH-、Cl- |
下列表示对应化学反应的离子方程式正确的是
| A.向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
| B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| D.向新制Cu(OH)2中加入乙醛溶液并加热: |
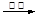 CH3COO-+Cu2O↓+3H2O
CH3COO-+Cu2O↓+3H2O 向含有下列离子的溶液中加入一小块金属钠,引起离子数目减少的是
| A.OH— | B.CO32— | C.HCO3— | D.Cl— |
下列各组离子中,在给定条件下能够大量共存的是
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
| B.无色溶液中:Mg2+、MnO4-、SO42-、K+ |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(ClO-)= 1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42- |
下列各组离子在指定分散系中一定能大量共存的是
A.pH=0的溶液中: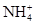 、Fe3+、 、Fe3+、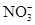 、Cl- 、Cl- |
B.明矾溶液中:Na+、Mg2+、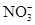 、 、 |
| C.氢氧化铁胶体中:H+、K+、Cl-、S2- |
D.使酚酞变红的溶液中:Na+、Ba2+、Cl-、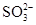 |
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32―、Cl一、SO42―,为确认溶液组成,现取100 mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g(经过滤、洗涤、干燥,下同),同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是
| A.一定存在Cl一 |
| B.一定存在A13+和NH4+ |
| C.一定不存在Mg2+,可能存在A13+ |
| D.溶液中SO42―的浓度是0. 3 mol/L |
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为2KMnO4+10FeSO4+ 8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如下图所示。
则下列有关说法不正确的是( )
| A.图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol |
| D.向C点以后的溶液中加入少量KSCN溶液,溶液变红色 |