题目内容
20. 现有常温下的0.1mol/L小苏打溶液,回答下列问题:
现有常温下的0.1mol/L小苏打溶液,回答下列问题:(1)该溶液呈碱性的原因是(离子方程式表示):HCO3-+H2O?H2CO3+OH-
(2)该溶液中,除了水的电离平衡外,还存在的电离平衡是:HCO3-?H++CO32-(离子方程式)
(3)常温下pH均为a的小苏打溶液和NaOH溶液中,水电离产生的c(OH-)之比为:102a-14:1
(4)关于该溶液中离子浓度的表述正确的是A(填序号)
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C.c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+)
D.c(Na+)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-)>c(H2CO3)
(5)加热该溶液,温度刚刚升高时,溶液的pH值增大(填“增大”“减小”“不变”),将溶液蒸干后,再灼烧至质量不再改变,得到固体的成分是Na2CO3(填化学式)
分析 (1)小苏打为NaHCO3,为强碱弱酸盐,水解显碱性;
(2)HCO3-为酸式弱酸根,既能水解又能电离;
(3)小苏打由于能水解,对水的电离有促进作用;NaOH是碱,对水的电离有抑制作用;
(4)A、根据小苏打溶液中的物料守恒来分析;
B、根据溶液中的电荷守恒来分析;
C、根据溶液中的质子守恒来分析;
D、根据NaHCO3溶液显碱性,HCO3-的水解大于其电离来分析;
(5)盐类水解吸热;将溶液蒸干、灼烧后,NaHCO3会受热分解.
解答 解:(1)小苏打为NaHCO3,为强碱弱酸盐,HCO3-能结合水电离出的氢离子而水解显碱性:HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
(2)HCO3-为酸式弱酸根,既能水解又能电离,故该溶液中,除了水的电离平衡外,还存在的电离平衡是HCO3-?H++CO32-,故答案为:HCO3-?H++CO32-;
(3)小苏打由于能水解,对水的电离有促进作用在pH=a的NaHCO3溶液中,OH-全部来自于水的电离出,而溶液中的C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-a}}$mol/L=10a-14mol/L;NaOH是碱,对水的电离有抑制作用,pH=a的氢氧化钠溶液中的H+全部来自于水的电离,故溶液中水电离出的C(H+)=10-amol/L,由于水电离出的H+和OH-的浓度相等,故溶液中水电离出的C(OH-)=10-amol/L.故两溶液中水电离产生的c(OH-)之比为10a-14:10-a=102a-14:1,故答案为:102a-14;
(4)A、小苏打NaHCO3中,钠原子和碳原子的比为1:1,由于HCO3-的水解,导致后来碳元素在溶液中的存在形式有3种:HCO3-、CO32-、H2CO3,根据小苏打NaHCO3溶液中的物料守恒可知:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B、由于HCO3-的水解,溶液中的离子有:Na+、H+、HCO3-、CO32-、OH-,根据溶液中的电荷守恒应有:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故B错误;
C、由于HCO3-能电离出H+,故溶液中的质子守恒为:c(OH-)=c(H2CO3)+c(H+)-c(CO32-),故C错误;
D、NaHCO3溶液显碱性,说明HCO3-的水解大于其电离,故溶液中的离子浓度的大小关系为;c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-),故D错误.
故选A.
(5)盐类水解吸热,故温度刚刚升高时,水解平衡右移,溶液的pH值增大;将溶液蒸干、灼烧后,NaHCO3会受热分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O
故得到的固体成分为Na2CO3.故答案为:增大;Na2CO3.
点评 本题考查了盐类的水解以及离子浓度大小比较,难度不大,应注意的是HCO3-的水解大于其电离.

| A. | H2、O3 | B. | H2SO4、H2CO3 | C. | SO2、NO | D. | Na2SO3、KClO3 |
| A. | K2CO3溶液中c(K+)与c(CO32-)之比 | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的KOH溶液与pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比 |
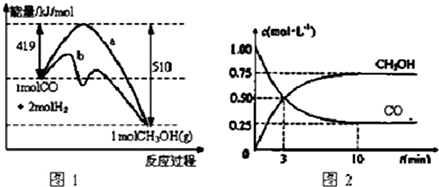

 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 .
.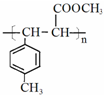 .
.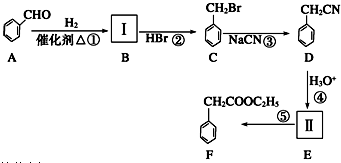
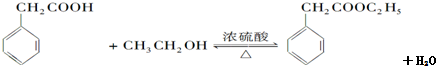 (要求写出反应条件).
(要求写出反应条件). (要求写出反应条件).
(要求写出反应条件). .
.