题目内容
化学是一门以实验为基础的自然学科,试剂的纯度是影响实验结果的一个重要因素.氢氧化钠是实验室的常备试剂,但因受空气的影响而含有碳酸钠杂质.学会从不同角度去分析问题一直是我们努力的方向,某化学研究性小组为测定混有碳酸钠的氢氧化钠样品的纯度提出如下几种实验方案.
方案一 称取m1g样品溶于水,滴加足量BaC12溶液至沉淀完全,过滤、洗涤、干燥、称重得固体m2g,计算NaOH的纯度.
(1)如何证明沉淀已洗涤干净______
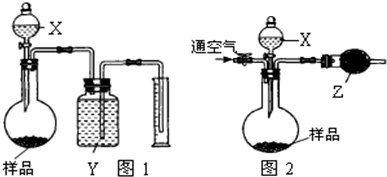
方案二 将m1g样品放入圆底烧瓶中,分液漏斗中装入足量试剂X,测量产生CO2的量有多种方式,该组甲、乙两位同学提出了不同方法.
甲同学利用图1装置测量产生CO2的体积
乙同学利用图2装置测量产生CO2的质量,乙同学的具体操作是:称量整个装置的质量为m2g,加入足量试剂X使样品完全反应,然后通入足量的空气后称量整个装置的质量为m3g.
(2)装置中的试剂分别是X:______ Y:______ Z:______
图1装置反应后烧瓶中总会留有CO2______ (填“是”、“否”)影响测出的CO2的体积.
图2装置中若没有通空气的操作,则测得NaOH的纯度______ (填“偏高”、“偏低”)
方案三 称取m g样品配成 V mL溶液,取V1 mL溶液滴加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,测出消耗盐酸的体积为V2 mL,用m、V、V1、V2、c(HCl)计算NaOH的纯度.
(3)根据方案三计算NaOH的纯度的表达式为(不必简化):______.

方案一 称取m1g样品溶于水,滴加足量BaC12溶液至沉淀完全,过滤、洗涤、干燥、称重得固体m2g,计算NaOH的纯度.
(1)如何证明沉淀已洗涤干净______
方案二 将m1g样品放入圆底烧瓶中,分液漏斗中装入足量试剂X,测量产生CO2的量有多种方式,该组甲、乙两位同学提出了不同方法.
甲同学利用图1装置测量产生CO2的体积
乙同学利用图2装置测量产生CO2的质量,乙同学的具体操作是:称量整个装置的质量为m2g,加入足量试剂X使样品完全反应,然后通入足量的空气后称量整个装置的质量为m3g.
(2)装置中的试剂分别是X:______ Y:______ Z:______
图1装置反应后烧瓶中总会留有CO2______ (填“是”、“否”)影响测出的CO2的体积.
图2装置中若没有通空气的操作,则测得NaOH的纯度______ (填“偏高”、“偏低”)
方案三 称取m g样品配成 V mL溶液,取V1 mL溶液滴加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,测出消耗盐酸的体积为V2 mL,用m、V、V1、V2、c(HCl)计算NaOH的纯度.
(3)根据方案三计算NaOH的纯度的表达式为(不必简化):______.
(1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可,检验方法是:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净),
故答案为:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净);
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度.
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳,故Z以选用无水CaCl2,图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠溶液;
图1装置反应后烧瓶中总会留有CO2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小,计算碳酸钠的质量偏小,氢氧化钠的纯度偏高,
故答案为:稀硫酸;饱和的碳酸氢钠溶液;无水CaCl2;否;偏高;
(3)V1 mL溶液中加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH-+H+=H2O,
消耗盐酸的物质的量为c(HCl)×V2×10-3mol,故V1 mL溶液中n(NaOH)=c(HCl)×V2×10-3mol,m g样品中含有氢氧化钠为
×c(HCl)×V2×10-3mol,mg样品中氢氧化钠的质量为
×c(HCl)×V2×10-3mol×40g/mol=
×c(HCl)×V2×10-3×40g,故样品中氢氧化钠纯度为
×100%,
故答案为:
×100%.
故答案为:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净);
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度.
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳,故Z以选用无水CaCl2,图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠溶液;
图1装置反应后烧瓶中总会留有CO2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小,计算碳酸钠的质量偏小,氢氧化钠的纯度偏高,
故答案为:稀硫酸;饱和的碳酸氢钠溶液;无水CaCl2;否;偏高;
(3)V1 mL溶液中加过量的BaCl2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH-+H+=H2O,
消耗盐酸的物质的量为c(HCl)×V2×10-3mol,故V1 mL溶液中n(NaOH)=c(HCl)×V2×10-3mol,m g样品中含有氢氧化钠为
| V |
| V1 |
| V |
| V1 |
| V |
| V1 |
| ||
| m |
故答案为:
| ||
| m |

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
下列观点不正确的是( )
| A、化学是一门以实验为基础的科学 | B、从宏观看,物质有时候处于相对静止状态,但从微观看,则是永恒运动的 | C、运用分类的方法,可根据物质所属的类别预测物质的性质 | D、世界是由物质组成的,物质都是由分子和原子组成的 |





