题目内容
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为_______。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A 的相对分子质量比B大14。
①该反应的化学反应方程式为_____________________。
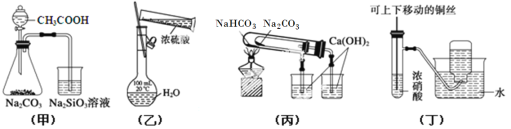
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为_________。

(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为________________________________。
【答案】(1)焊接钢轨;
(2)4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)2Na2O2+2H2O=4NaOH+O2↑;
(4)①CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②C2H5OH﹣4e﹣+H2O=CH3COOH+4H+;
(5)2ClO2+5Mn2++6H2O=5MnO2↓+2Cl﹣+12H+.
【解析】
(1)高温条件下,铝和氧化铁发生铝热反应而放出大量热而使铁熔融,所以能用于焊接钢轨,故答案为:焊接钢轨;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,则A是氨气,氨气在催化剂、加热条件下能和氧气反应生成NO和水,反应方程式为4NH3+5O2![]() 4NO+6H2O,(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
4NO+6H2O,(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A的相对分子质量比B大14,A能和B反应生成C和D,A为乙酸、B为乙醇;
①在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应,反应方程式为CH3COOH+C2H5OH![]() CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH
CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②该燃料电池中,负极上乙醇失电子发生氧化反应,该电解质溶液呈酸性,所以生成氢离子和二氧化碳,电极反应式为C2H5OH﹣4e﹣+H2O=CH3COOH+4H+,故答案为:C2H5OH﹣4e﹣+H2O=CH3COOH+4H+;
(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl﹣,根据反应物和生成物及转移电子守恒书写离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl﹣+12H+.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。