题目内容
9.下列叙述正确的是( )| A. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同位素,化学性质相似 | |
| B. | C(石墨,s)=C(金刚石,s)△H>0,所以石墨比金刚石稳定 | |
| C. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| D. | 常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存 |
分析 A.同位素的分析对象为原子,而氧气为单质;
B.△H>0,则石墨的能量低,石墨稳定;
C.明矾水解生成胶体吸附净化,而漂白粉具有强氧化性;
D.pH=1的水溶液,显酸性,离子之间发生氧化还原反应或复分解反应.
解答 解:A.${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互为同种单质,化学性质相似,故A错误;
B.C(石墨,s)=C(金刚石,s)△H>0,可知石墨的能量低,所以石墨比金刚石稳定,故B正确;
C.明矾水解生成胶体吸附净化,而漂白粉具有强氧化性,漂白粉可杀菌消毒,原理不同,故C错误;
D.pH=1的水溶液,显酸性,H+、NO3-、Fe2+发生氧化还原反应,HCO3-、H+发生复分解反应生成气体和水,不能大量共存,故D错误;
故选B.
点评 本题考查较综合,涉及反应热、离子共存及水的净化等,注重高频考点的考查,把握相关反应原理及物质的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列各组离子中,能在溶液中大量共存的是( )
| A. | Ba2+ Cl- Na+ SO42- | B. | Ag+ NO3- K+ CO32- | ||
| C. | Cu2+ Cl- Ag+ OH- | D. | Na+ OH- K+ SO42- |
20.室温下,向VmLpH=a的盐酸中滴加pH=b的NaOH溶液10VmL,所得溶液中c(Cl-)=c(Na+)则此时(a+b)的值为( )
| A. | 15 | B. | 14 | C. | 13 | D. | 不能确定 |
17.以下分离或提纯的方法中正确的是( )
| A. | 分离碘水中的碘--升华 | |
| B. | 分离白酒中的酒精和水--分液 | |
| C. | 除去海盐中的硫酸盐--溶解后加硝酸钡 | |
| D. | 分离海水中的水--蒸馏 |
4.关于O3的说法中错误的是( )
①O3具有刺激性臭味,因此被称为“臭氧”
②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水
④O3比O2稳定,高温下不易分解
⑤臭氧有漂白和消毒作用
⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好
⑦空气中高压放电、高压电机和复印机工作都会有O3生成.
①O3具有刺激性臭味,因此被称为“臭氧”
②O2与O3是氧元素的同素异形体
③O3比O2密度大,也比O2易溶于水
④O3比O2稳定,高温下不易分解
⑤臭氧有漂白和消毒作用
⑥空气中微量O3可以刺激中枢神经,加快血液循环,因此空气中O3含量越高越好
⑦空气中高压放电、高压电机和复印机工作都会有O3生成.
| A. | ①②③ | B. | ④⑤⑥ | C. | ④⑥ | D. | ⑤⑦ |
14.化学是以一门实验为基础的自然科学,许多实验有丰富的颜色变化,有关实验的颜色变化有错误的是( )
| A. | 向FeSO4和KSCN的混合溶液中滴加少量的新制氯水,溶液由浅绿色变为红色 | |
| B. | 向FeSO4溶液中滴加NaOH溶液,生成沉淀的颜色由白色迅速变为灰绿色,最后变为红褐色 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸,能使溶液变为棕黄色 | |
| D. | 将Fe(OH)3胶体装在U形管中做电泳实验时,负(阴)极一端颜色变浅 |
3.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1实验装置.请回答:
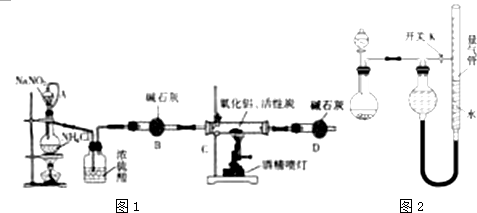
(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出样品中AlN的质量分数为61.5%.

(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 氮化铝样品质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 350.0mL | 13.7mL |
| ② | 1.0g | 350.0mL | 25.0mL |
| ③ | 1.0g | 350.0mL | 14.3mL |
20.下列金属在空气中,能自发形成氧化物保护膜的是( )
| A. | 铁 | B. | 铝 | C. | 铜 | D. | 钠 |
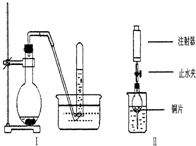 如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: