题目内容
某研究性学习小组探究金属锈蚀的条件,进行如下对照实验: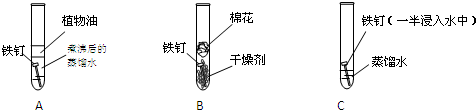
【实验现象】数天后铁钉锈蚀情况:A无锈蚀,B无锈蚀,C有锈蚀;
【实验结论】金属锈蚀的条件是
【结论分析】铁钉生锈主要属于
【拓展应用】写出金属防护的一种常用方法
分析:金属腐蚀的本质是金属原子失去电子被氧化的过程,金属腐蚀一般可分为化学腐蚀与电化学腐蚀.
电化学腐蚀是金属的腐蚀中最普遍、也是最重要的一种类型.金属在潮湿的空气中容易发生的腐蚀是电化学腐蚀;金属和氧化性物质直接接触发生的是化学腐蚀.通过三个实验的对比,可知在潮湿的环境下即要在水和氧同时存在的环境中.
金属防护的方法金属腐蚀的防护主要方法有:①改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.②在金属表面覆盖保护层.例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等.③电化学保护法:a.外加电流的阴极保护法、牺牲阳极的阴极保护法.
电化学腐蚀是金属的腐蚀中最普遍、也是最重要的一种类型.金属在潮湿的空气中容易发生的腐蚀是电化学腐蚀;金属和氧化性物质直接接触发生的是化学腐蚀.通过三个实验的对比,可知在潮湿的环境下即要在水和氧同时存在的环境中.
金属防护的方法金属腐蚀的防护主要方法有:①改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.②在金属表面覆盖保护层.例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等.③电化学保护法:a.外加电流的阴极保护法、牺牲阳极的阴极保护法.
解答:解:【实验结论】通过实验现象:A中铁钉与水接触但是与氧气隔绝不被腐蚀;B中铁钉与氧气接触但是与水隔绝不被腐蚀;C铁钉与氧气、水接触发生腐蚀,可知金属的腐蚀条件是在水和氧同时存在的环境,故答案为:水和氧同时存在的环境;
【结论分析】铁钉在潮湿的空气中容易发生的腐蚀是电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀,在酸性介质中发生析氢腐蚀,在中性或弱碱性环境下发生吸氧腐蚀,铁钉在水中发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+ 故答案为:电化学; Fe-2e-=Fe2+;
【拓展应用】金属防护的方法金属腐蚀的防护主要方法有:①改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.②在金属表面覆盖保护层.例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等.③电化学保护法:a.外加电流的阴极保护法、牺牲阳极的阴极保护法,
故答案为:外接电源的阴极保护法.
【结论分析】铁钉在潮湿的空气中容易发生的腐蚀是电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀,在酸性介质中发生析氢腐蚀,在中性或弱碱性环境下发生吸氧腐蚀,铁钉在水中发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+ 故答案为:电化学; Fe-2e-=Fe2+;
【拓展应用】金属防护的方法金属腐蚀的防护主要方法有:①改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.②在金属表面覆盖保护层.例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等.③电化学保护法:a.外加电流的阴极保护法、牺牲阳极的阴极保护法,
故答案为:外接电源的阴极保护法.
点评:本题通过实验探究考查了金属腐蚀与防护,难度较小,解题时注意三个实验的对照.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径. CO+3H2
CO+3H2