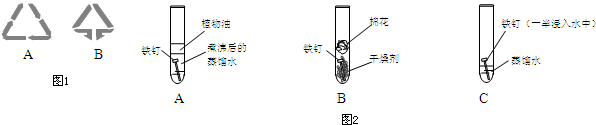
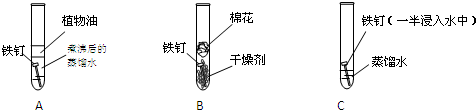
题目内容
某研究性学习小组探究用氯化铁溶液腐蚀印刷电路铜箔板,请你选用烧杯、氯化钾琼脂盐桥(必用)及导线、电极(自选)、电解质溶液(自选)若干(若缺少可自行添加).
(1)在空白处画出装置图,指出电极和电解质名称 .
(2)该小组有一成员突发奇想:用该装置测阿伏伽德罗常数.给你天平、秒表、烘箱,你觉得还缺少的一个必须测量仪器是 ,已知被腐蚀铜箔的质量为m克,每个电子的电量为q库伦,铜箔腐蚀时间为t秒,你选用的测量仪器在测量时间内为x“单位”,其“单位”也为国际单位,不考虑其它误差因素,则阿伏伽德罗常数的计算式= .
(1)在空白处画出装置图,指出电极和电解质名称
(2)该小组有一成员突发奇想:用该装置测阿伏伽德罗常数.给你天平、秒表、烘箱,你觉得还缺少的一个必须测量仪器是
分析:(1)铜和氯化铁溶液的反应中,铜失电子发生氧化反应,铁离子得电子发生还原反应,所以设计成原电池时,铜作负极,不如铜活泼的金属或导电的非金属作正极,铜电极所在的电解质溶液为氯化铜溶液,正极所在的溶液为氯化铁反应;
(2)根据Q=It知,测量仪器是电流计或电流表;
根据Q=It、N=nNA=
×2×NA,得Q=It=
q,从而得出NA的值.
(2)根据Q=It知,测量仪器是电流计或电流表;
根据Q=It、N=nNA=
| m |
| M |
| 2mNA |
| M |
解答:解:(1)铜和氯化铁溶液的反应中,铜失电子发生氧化反应而作负极,不如铜活泼的金属或导电的非金属作正极,如石墨,铜电极所在的电解质溶液为可溶性氯化铜溶液,该电池反应中,铁离子得电子发生还原反应,所以正极所在的溶液为氯化铁溶液,所以其装置图为: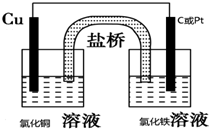 ,
,
故答案为:负极为铜,正极为石墨,左边电解质溶液为氯化铜溶液,右边为氯化铁溶液;
(2)根据Q=It知,测量仪器是电流计或电流表,用来测量电流;
根据Q=It、N=nNA=
×2×NA,得Q=It=
q,则NA=
/mol=
/mol=
/mol,
故答案为:电流计或电流表;
.
 ,
,故答案为:负极为铜,正极为石墨,左边电解质溶液为氯化铜溶液,右边为氯化铁溶液;
(2)根据Q=It知,测量仪器是电流计或电流表,用来测量电流;
根据Q=It、N=nNA=
| m |
| M |
| 2mNA |
| M |
| ItM |
| 2mq |
| It×64 |
| 2mq |
| 32It |
| mq |
故答案为:电流计或电流表;
| 32It |
| mq |
点评:本题考查了原电池的设计、阿伏伽德罗常数的测定等知识点,根据原电池原理来设计原电池,根据电量相等计算阿伏伽德罗常数,难度中等.

练习册系列答案
相关题目
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:

 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径. CO+3H2
CO+3H2