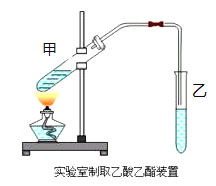
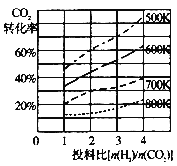
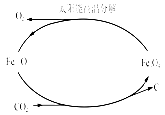
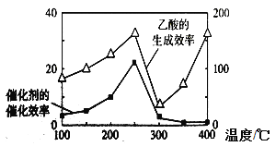
题目内容
【题目】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
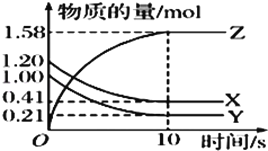
(1)该反应的化学方程式为_____。
(2)从反应开始到10s时,用Y表示的反应速率为________,X的转化率为_____。(均保留三位有效数字)
(3)10s时,该反应___达到了化学平衡状态。(填“是”或“否”)
【答案】 X(g)+Y(g)2Z(g) 0.0395 molL﹣1s﹣1 65.8% 是
【解析】(1)根据图像可知Y和X的物质的量分别减少1mol-0.21mol=0.79mol、1.2mol-0.41mol=0.79mol,Z的物质的量增加1.58mol,变化量之比是相应的化学计量数之比,因此该反应的化学方程式为X(g)+Y(g)2Z(g)。(2)从反应开始到10s时,用Y表示的反应速率为![]() =0.0395 molL﹣1s﹣1 ,X的转化率为0.79/1.2×100%=65.8%。(3)10s时物质的浓度不再发生变化,该反应达到了化学平衡状态。
=0.0395 molL﹣1s﹣1 ,X的转化率为0.79/1.2×100%=65.8%。(3)10s时物质的浓度不再发生变化,该反应达到了化学平衡状态。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目