题目内容
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
O2(g)═CO2(g)+2H2(g)△H=﹣192.9kJmol﹣1
下列说法正确的是( )
A.CH3OH的燃烧热为192.9 kJmol﹣1
B.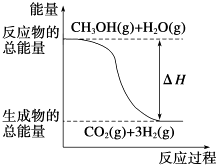
反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
O2(g)═CO2(g)+2H2(g)的△H>﹣192.9 kJmol﹣1
【答案】D
【解析】解:A、反应②生成氢气,不符合燃烧热的概念,故A错误;
B、图中表示的是放热反应,而反应①是吸热反应,图象不符合,故B错误;
C、据反应①②可知,CH3OH转变成H2的过程不一定要吸收能量,故C错误;
D、反应②气态甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol液态 CH3OH充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ,故D正确;
故选D.
A、燃烧热是指1mol可燃物完全燃烧生成稳定的化合物时放出的热量;
B、反应①是吸热反应,反应物能量小于生成物;
反应①是吸热反应,反应②是放热反应,对比反应的热化学方程式可知等物质的量的气态水能量低于氧气的能量;
C、据反应①②分析;
D、依据反应②甲醇反应生成二氧化碳和氢气的焓变是﹣192.9kJ/mol;而1 mol CH3OH气态变化为液态放热,充分燃烧生成二氧化碳和水放出的热量小于192.9 kJ.

【题目】如表是元素周期表的一部分,按要求填空( 填元素符号或化学式):
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①元素的元素名称 .
(2)写出⑩元素的元素符号 .
(3)⑨在元素周期表中的位置:第周期,第族.
(4)在这些元素中,是最活泼的金属元素;是最活泼的非金属元素;是最不活泼的元素.(用元素符号填写)
(5)能形成气态氢化物,且气态氢化物最稳定的是 . (用化学式填写)
(6)这些元素的最高价氧化物对应水化物中最强的酸是;最强的碱是;具有两性的氢氧化物是 . (用化学式填写)
(7)从⑤到的元素中,原子半径最小.(用元素符号填写)
(8)比较⑤与⑥的化学性质,更活泼(用元素符号填写),试用实验证明此现象(简述实验操作、现象和结论) .
(9)用电子式表示元素④与⑥形成的化合物: , 该化合物属于(填“共价”或“离子”)化合物.