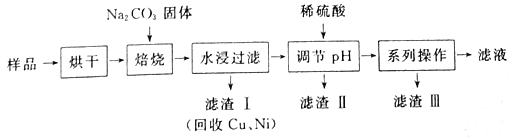
题目内容
【题目】磷单质及其化合物有广泛应用。
(1)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,三聚磷酸钠(俗称“磷酸五钠”)是常用的水处理剂,其化学式为________________。
(2)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为_________。
②化学镀镍的溶液中含有Ni2+和H2PO![]() ,在酸性条件下发生下述反应,请配平:
,在酸性条件下发生下述反应,请配平:
____Ni2++____H2PO![]() +____===____Ni++____H2PO
+____===____Ni++____H2PO![]() +____
+____
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为
2Ca3(PO4)2+6SiO2![]() 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10![]() P4+10CO
P4+10CO
若反应生成31 g P4,则反应过程中转移的电子数为___________(用NA表示阿伏加德罗常数的值)。
【答案】 Na5P3O10 +1价 2 1 1 H2O 2 1 2 H+ 5NA
【解析】(1)磷酸分子间通过羟基脱水形成三聚磷酸,所以三聚磷酸的结构式为: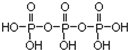 ;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,故答案为:Na5P3O10;
;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠(俗称“五钠”),所以三聚磷酸钠的化学式为:Na5P3O10,故答案为:Na5P3O10;
(2)①根据正负化合价的代数和为0,NaH2PO2中钠元素为+1价,H元素为+1价,O元素为-2价,则P元素的化合价为+1价,故答案为:+1价;
②由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,故答案为:1;1;H2O;1;1;2H+;
(3) 31 g P4的物质的量为![]() =0.25mol,根据方程式10C+P4O10
=0.25mol,根据方程式10C+P4O10![]() P4+10CO,反应中P由+5价变成0价,因此转移的电子为0.25mol×20=5mol,数目为5NA,故答案为:5NA。
P4+10CO,反应中P由+5价变成0价,因此转移的电子为0.25mol×20=5mol,数目为5NA,故答案为:5NA。