题目内容
【题目】钢铁制品经常进行烤蓝处理,主要目的是在表面生成一层致密的Fe3O4。为了研究烤蓝铁片,把一定量烤蓝铁片加工成均匀粉末,取mg该粉末,放入28.00 mL 1.000mol·L-1的盐酸中,恰好完全反应,生成134.4 mL气体(标准状况)。向反应后的溶液中滴入KSCN溶液,无明显现象。
(1)计算mg样品中n(Fe3O4)=______mol。
(2)写出具体计算过程∶_______________。
【答案】0.002或0.002000 n(HCl)=28.00mL×10-3mL·L-1×1.000mol·L-1=0.028mol, n(H2)=![]() ;与盐酸反应后的溶液中溶质只有FeCl2,根据关系是FeCl2~2Cl-,可得溶液中n(FeCl2)=0.028mol÷2=0.014mol;
;与盐酸反应后的溶液中溶质只有FeCl2,根据关系是FeCl2~2Cl-,可得溶液中n(FeCl2)=0.028mol÷2=0.014mol;
设n(Fe3O4) =x mol,有:
![]()
![]()
![]()
得x=![]() 。
。
【解析】
烤蓝铁片中含有Fe3O4,Fe3O4和盐酸反应生成FeCl3和FeCl2,加入KSCN后,溶液没有呈现红色,说明溶液中没有Fe3+,结合有H2放出,说明原粉末中含有Fe,发生了Fe3+和Fe的反应。
整个过程发生的反应有Fe3O4+8HCl=2FeCl3+FeCl2+4H2O、2FeCl3+2Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑。n(HCl)=28.00mL×10-3mL·L-1×1.000mol·L-1=0.028mol;与盐酸反应后的溶液中溶质只有FeCl2,根据关系是FeCl2~2Cl-,可得溶液中n(FeCl2)=0.028mol÷2=0.014mol;
与盐酸反应放出氢气的Fe:Fe~H2,n(H2)=![]() ;根据
;根据![]()
可知与盐酸反应的Fe的物质的量为0.006mol;得到FeCl2的物质的量为0.006mol;
假设Fe3O4的物质的量为xmol,有:
![]()
![]()
可得4x=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
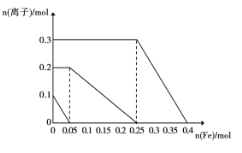
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
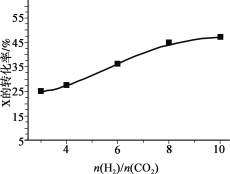
① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。