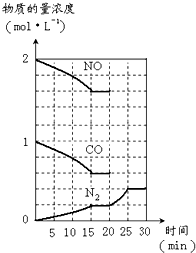
题目内容
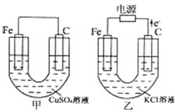 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:(1)甲池中的现象为:
(2)甲池中总反应的离子方程式为:
(3)乙池中总反应的离子方程式为:
(4)将湿润的淀粉KI试纸放在乙池碳棒附近,发现试纸变蓝,其原因是:(用离子方程式表示)
(5)若乙池的电源连接方向开始时就与上述的图示相反,则反应一段时间后,其溶液中可能出现的现象是
分析:由图可知,甲为原电池,负极为Fe,电池反应为Fe+Cu2+═Fe2++Cu,乙为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-,以此来解答.
| ||
解答:解:(1)甲中发生Fe+Cu2+═Fe2++Cu,观察到铁棒逐渐溶解,碳棒上有红色物质析出,蓝色溶液逐渐变浅,
故答案为:铁棒逐渐溶解,碳棒上有红色物质析出,蓝色溶液逐渐变浅;
(2)电池反应为Fe+Cu2+═Fe2++Cu,故答案为:Fe+Cu2+═Fe2++Cu;
(3)乙为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(4)乙池碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:Cl2+2I-═I2+2Cl-;5Cl2+I2+6H2O═2HIO3+10HCl;
(5)若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色絮状沉淀,故答案为:产生白色絮状沉淀.
故答案为:铁棒逐渐溶解,碳棒上有红色物质析出,蓝色溶液逐渐变浅;
(2)电池反应为Fe+Cu2+═Fe2++Cu,故答案为:Fe+Cu2+═Fe2++Cu;
(3)乙为电解池,由电子流向正极可知,C为阳极,Fe为阴极,电解反应为2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(4)乙池碳棒附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:Cl2+2I-═I2+2Cl-;5Cl2+I2+6H2O═2HIO3+10HCl;
(5)若乙池的电源连接方向开始时就与上述的图示相反,则Fe为阳极,失去电子,阴极氢离子放电生成氢气,生成的亚铁离子与氢氧根离子反应生成氢氧化亚铁,观察到产生白色絮状沉淀,故答案为:产生白色絮状沉淀.
点评:本题考查原电池和电解池,装置的判断是解答的关键,注意把握原电池和电解池的工作原理,明确离子的放电顺序及发生的电极反应即可解答,题目难度中等.

练习册系列答案
相关题目
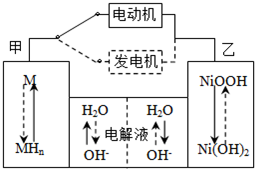



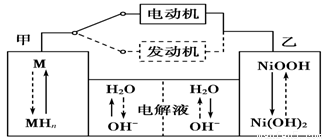
 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电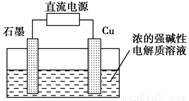
 Cu2O+H2↑,阴极的电极反应式是_____________________。
Cu2O+H2↑,阴极的电极反应式是_____________________。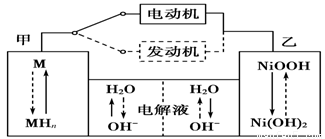
 2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电
2Ni(OH)2。根据所给信息判断,混合动力车上坡或加速时,甲电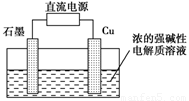
 Cu2O+H2↑,阴极的电极反应式是_____________________。
Cu2O+H2↑,阴极的电极反应式是_____________________。