题目内容
(2011?烟台模拟)第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.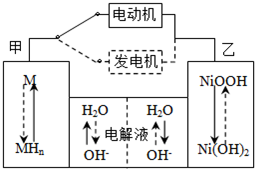
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH
2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.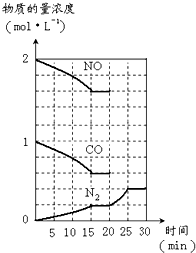
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=
若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④

(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为
C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1
C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1
.(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH
| 放电 | 充电 |
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH
增大
增大
(填“增大”、“减小”或“不变”),该电极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-
NiOOH+H2O+e-=Ni(OH)2+OH-
.(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.

若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=
0.027mol?L-1?min-1
0.027mol?L-1?min-1
(结果保留两位有效数字).若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将
不
不
移动(填“向左”、“向右”或“不”). 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是b
b
(填字母).①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④
分析:(1)生成1mol水蒸气放出569.1kJ热量,则生成9mol水放出5121.9kJ热量,据此写出其热化学反应方程式;
(2)混合动力车上坡或加速时,电动机提供推动力,则该装置相当于原电池,电池中镍的化合物为正极,正极上得电子发生还原反应,根据乙电极附近氢氧根离子浓度变化确定pH变化;
(3)先根据v=
计算NO的平均反应速率,再根据同一化学反应中,各物质的反应速率之比等于其计量数之比计算二氧化碳的平均反应速率;温度不变,化学平衡常数不变,根据浓度积常数与化学平衡常数的相对大小确定平衡是否移动;根据外界条件对化学平衡的影响分析.
(2)混合动力车上坡或加速时,电动机提供推动力,则该装置相当于原电池,电池中镍的化合物为正极,正极上得电子发生还原反应,根据乙电极附近氢氧根离子浓度变化确定pH变化;
(3)先根据v=
| △C |
| △t |
解答:解:(1)生成1mol水蒸气放出569.1kJ热量,则生成9mol水放出5121.9kJ热量,所以其热化学反应方程式为:C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1,
故答案为:C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1;
(2)混合动力车上坡或加速时,电动机提供推动力,则该装置相当于原电池,正极上发生反应为 NiOOH+H2O+e-=Ni(OH)2+OH-,氢氧根离子浓度增大,所以溶液的pH增大,故答案为:增大,NiOOH+H2O+e-=Ni(OH)2+OH-;
(3)一氧化氮的反应速率=
mol/L.(min)=0.027 mol?L-1?min-1,二氧化碳和一氧化氮的反应速率相等,所以二氧化碳的反应速率也是0.027 mol?L-1?min-1,
15min时,二氧化碳的物质的量浓度是氮气的2倍为0.4mol/L,化学平衡常数K=
=0.035,
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
=0.035=K,平衡不动,20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:不移动;
故答案为:0.027 mol?L-1?min-1,不,b.
故答案为:C8H18(l)+25/2O2(g)═8CO2(g)+9H2O(g),△H=5121.9kJ?mol-1;
(2)混合动力车上坡或加速时,电动机提供推动力,则该装置相当于原电池,正极上发生反应为 NiOOH+H2O+e-=Ni(OH)2+OH-,氢氧根离子浓度增大,所以溶液的pH增大,故答案为:增大,NiOOH+H2O+e-=Ni(OH)2+OH-;
(3)一氧化氮的反应速率=
| 2-1.6 |
| 15 |
15min时,二氧化碳的物质的量浓度是氮气的2倍为0.4mol/L,化学平衡常数K=
| 0.2×(0.4)2 |
| (1.6)2.(0.6)2 |
若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
| 0.8×(0.4)2 |
| (1.2)2.(1.6)2 |
故答案为:不移动;
故答案为:0.027 mol?L-1?min-1,不,b.
点评:本题考查热化学方程式、化学平衡影响因素分析、平衡常数、速率的计算方法,平衡移动原理的应用,原电池、电解池原理分析应用,题目难度较大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
 (2011?烟台模拟)水的电离平衡曲线如图所示:
(2011?烟台模拟)水的电离平衡曲线如图所示: