题目内容
设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
| A.标准状况下,2.24 L苯中约含有个NA碳原子 |
| B.标准状况下,22.4 L H2中含中子数为2NA |
| C.1 L 1 mol/L醋酸溶液中离子总数为2 NA |
| D.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 |
D
解析试题分析:A、标准状况下苯不是气态,不能适用于气体摩尔体积,A错误;B、标准状况下22.4L氢气的物质的量是1mol,但H原子中不含有中子,B错误;C、醋酸是弱电解质,存在电离平衡,因此1 L 1 mol/L醋酸溶液中离子总数小于NA个,C错误;D、镁是活泼的金属,在反应中均是失去2个电子,则1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子,D正确,答案选D。
考点:考查阿伏伽德罗常数的有关计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
| |||||||||||||||
工业生产中物质制备时,通过下列反应原理一步完成获得产物、符合“绿色化学”原则的反应是
| A.加成反应 | B.分解反应 | C.取代反应 | D.置换反应 |
在T℃时,将ag NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为W,其中含NH4+的物质的量为bmol。下列叙述中正确的是 ( )
A.溶质的质量分数为 |
| B.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
C.溶液中 |
D.溶质的物质的量浓度 |
设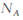 为阿伏加德罗常数的数值,下列说法正确的是
为阿伏加德罗常数的数值,下列说法正确的是
A.标准状况,1molSO3含O原子个数为3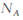 |
B.1.12LN2中含N2分子数为0.05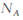 |
C.5.6gFe与足量稀盐酸反应,转移的电子数为0.3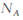 |
D.常温下pH=1的H2SO4溶液中,H+的个数为0.1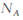 |
同温同压下,aLXm气体和bLYn气体化合,生成cL的化合物z,则z的化学式为( )
| A.XaYb | B.XnYm | C.XamYbn | D. |
(原创) 下列化学用语使用正确的是
| A.N2的结构式:N = N |
B.H2O的比例模型: |
C.HClO的电子式: |
D.MgBr2的形成过程用电子式表示为: |