题目内容
8.下列离子方程式与所述事实实相符且正确的是( )| A. | 漂白粉溶液再空气中失效:ClO-+CO2+H2O═HClO+HCO${\;}_{3}^{-}$ | |
| B. | 用浓盐酸与反应制取少量氯气MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2制Al(OH)3 AlO2 -+CO2+2H2O=Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO${\;}_{4}^{2-}$+3Cl-+H2O+4H+ |
分析 A.次氯酸钙与空气中的二氧化碳反应生成碳酸钙和次氯酸;
B.原子个数、电荷数都不守恒;
C.偏铝酸钠与过量二氧化碳反应生成氢氧化铝和碳酸氢钠;
D.碱性溶液中不能生成氢离子.
解答 解:A.漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+CaCO3↓,故A错误;
B.用浓盐酸与反应制取少量氯气,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故B错误;
C.偏铝酸钠与过量二氧化碳反应生成氢氧化铝和碳酸氢钠,离子方程式为:AlO2 -+CO2+2H2O=Al(OH)3↓+HCO3-,故C正确;
D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4,离子方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式应遵循原子个数守恒、电荷守恒规律,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
15.某澄清透明溶液中,可能大量存在下列离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Br-、AlO2-、Cl-、SO42-、CO32-,现进行如下实验:
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出.将溶液分为3份.
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清.加热,将湿润的红色石蕊试纸置于试管口,未见明显现象.
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色.
则下列推断正确的是( )
①用试管取少量溶液,逐滴加入稀盐酸至过量,溶液先浑浊后又变澄清,有无色气体放出.将溶液分为3份.
②在第1份溶液中逐滴加入NaOH溶液至过量,溶液先浑浊后又变澄清.加热,将湿润的红色石蕊试纸置于试管口,未见明显现象.
③在第2份溶液中加入新制的氯水和CCl4,振荡后静置,下层溶液显橙红色.
则下列推断正确的是( )
| A. | 溶液中一定有K+、Br-、CO32-、AlO2- | |
| B. | 溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ | |
| C. | 不能确定溶液中是否有K+、SO42-、Cl- | |
| D. | 往第3份溶液中滴加BaCl2可确认是否有SO42- |
16.下列物质在给定条件下同分异构体数目正确的是( )
| A. | C4H10属于烷烃的同分异构体有3种 | |
| B. | 分子组成是C5H10O2属于羧酸的同分异构体有5种 | |
| C. | 分子组成是C4H80属于醛类的同分异构体有3种 | |
| D. | 结构为 的一溴代物有5种 的一溴代物有5种 |
3.X、Y、Z、W、M均为短周期元素,X,Y同主族,X的氯化物和其最高氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第三周期连续的三种元素,其中只有一种是非金属元素,且原子半径Z>W>M.下列叙述正确的是( )
| A. | X、M两元素最简单氢化物的稳定性:X<M | |
| B. | Z、W、M的单质均能与稀硫酸反应制取氧气,且反应剧烈程度依次减弱 | |
| C. | Y的最高价含氧酸的化学式为H2YO2 | |
| D. | W和M的氧化物均可作耐高温材料 |
20.与下列事实对应的化学用语错误是( )
| A. | 纯碱溶液能清洗油污:CO32-+H2O?HCO3-+OH- | |
| B. | 配制FeSO4溶液时加入适量的铁粉:Fe3++Fe→2Fe2+ | |
| C. | 含1molNaOH和1molNa2CO3的混合溶液中滴入含1.5molHCl的稀盐酸:2OH-+CO32-+3H+→HCO3-+2H2O | |
| D. | NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-→2BaSO4↓+AlO2-+2H2O |
17.X、Y、Z、W、M是元素周期表中原子序数依次增大的五种元素,其相关信息如表:
(1)W位于元素周期表第三周期第ⅢA族;W的简单离子半径比Z的简单离子半径小(填“大’’或“小”).
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| 元素 | 相关信息 |
| X | 元素周期表中核电荷数最小的元素 |
| y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是
3d104s1
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线型
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
18.混合下列各组物质使之充分反应,将所得混合物加热蒸干,并在300℃灼烧至质量不变为止,最终残留固体为纯净物的是( )
| A. | 向CuSO4溶液中加入适量铁粉 | B. | 等浓度等体积的(NH4)2SO4和BaCl2 | ||
| C. | 等物质的量的NaHCO3和Na2O2 | D. | 在NaBr溶液中通入过量的Cl2 |

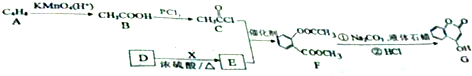
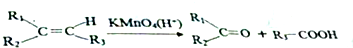
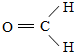 .
.